
Abstrak
Baterai ion-fluorida (FIB) yang seluruhnya padat merupakan kandidat yang sangat prospektif untuk baterai generasi berikutnya karena kepadatan energinya yang lebih unggul dan keamanannya terhadap baterai ion-litium (LIB). Meskipun demikian, potensi penuh FIB masih belum terealisasi, karena bahan katode yang praktis masih sulit dipahami. Di sini, perovskit oksifluorida SrFeO 2 F x dilaporkan menunjukkan F − (de)interkalasi topotaktik dan menyediakan kapasitas besar sebesar 350 mAh g −1 (1843 mAh cm −3 ) dengan ekspansi volume yang sangat kecil (≈0,5%). Kapasitas besar ini disebabkan oleh kelebihan F − (de)interkalasi sebesar ≈2,3 mol dalam SrFeO 2 F x dengan redoks Fe 2+ /Fe 3+ dan redoks oksigen. Lebih jauh lagi, CaFeO 2 F x yang disubstitusi Sr (Ca 0,8 Sr 0,2 FeO 2 F x ) memiliki kapasitas tertinggi sebesar 580 mAh g −1 (2595 mAh cm −3 ) di antara bahan katode yang menggunakan (de)interkalasi ion topotaksis, termasuk LIB. Untuk pertama kalinya, kemungkinan disajikan bahwa pemanfaatan redoks anion pamungkas yang terkait dengan (de)interkalasi ion untuk mencapai kapasitas spesifik yang melampaui bahan aktif saat ini lebih dari dua kali lipat.
1 Pendahuluan
Perangkat penyimpanan energi elektrokimia menjadi sangat penting untuk mewujudkan masyarakat yang berkelanjutan. [ 1 ] Baterai ion litium (LIB) telah mencapai kesuksesan komersial yang luas selama lebih dari 30 tahun karena kepadatan energinya yang tinggi dan umurnya yang panjang. Namun, adopsi kendaraan listrik yang sedang berkembang pesat telah mengintensifkan kebutuhan akan baterai isi ulang dengan kepadatan energi yang lebih tinggi, di samping keamanan yang lebih tinggi dan biaya yang lebih rendah daripada LIB yang mendominasi pasar. Untuk memenuhi permintaan ini, berbagai jenis baterai isi ulang generasi berikutnya yang menggunakan ion pembawa alternatif (misalnya, Li + , Na + , Mg 2+ , Cl − , F − ) telah diusulkan. [ 2 ] Di antara mereka, baterai ion fluorida (FIB) yang semuanya padat, yang menggunakan F − sebagai pembawa, sangat menjanjikan. Mereka menawarkan kepadatan energi teoritis tinggi yang tidak terduga yang dimungkinkan oleh reaksi multi-elektron dan menjamin keamanan menggunakan elektrolit anorganik yang tidak mudah terbakar. [ 2 , 3 ] Selain itu, FIB yang seluruhnya berupa padatan dengan kerapatan daya yang lebih unggul, mirip dengan LIB yang seluruhnya berupa padatan, diharapkan dapat terbentuk jika tersedia elektrolit padat dengan konduktivitas tinggi. [ 4 ]
Katoda logam/logam fluorida tipe konversi yang umum, seperti Cu/CuF 2, menunjukkan kapasitas tinggi menggunakan reaksi multi-elektron. [ 2 , 3 ] Namun, perubahan volume yang besar saat siklus pengisian/pengosongan menyebabkan kehilangan kontak antara material aktif dan elektrolit padat, yang menyebabkan berkurangnya kemampuan siklus dan kinerja laju. [ 5 ] Untuk mengurangi masalah ini, penelitian telah difokuskan pada pengembangan katoda tipe interkalasi, yang diuntungkan oleh kisi host yang kaku dan memungkinkan reaksi topotaktik (de)interkalasi F − dengan perubahan volume minimal. Berbagai katoda tipe interkalasi telah dikembangkan seperti LaSrMnO 4 [ 6 ] dan Sr 3 FeO 5 F 2 [ 7 ] dengan struktur perovskit Ruddlesden−Popper. [ 8 ] Meskipun senyawa ini mempunyai keuntungan berupa perubahan volume yang lebih kecil selama pengisian/pengosongan dibandingkan dengan logam/logam fluorida biasa, namun kapasitas yang kurang memuaskan akibat berat rumus senyawa induknya yang besar merupakan kerugian intrinsiknya.
Namun, untuk meningkatkan kapasitas yang tidak memuaskan, Miki et al. telah menunjukkan bahwa La 1.2 Sr 1.8 Mn 2 O 7-δ F 2 oxyfluoride [ 9 ] dapat menyediakan kapasitas reversibel tinggi sebesar 200 mAh g −1 menggunakan redoks oksigen seperti yang diamati pada oksida logam berlebih Li. [ 10 ] Dalam La 1.2 Sr 1.8 Mn 2 O 7-δ F 2 oxyfluoride, situs anion intrinsik dalam lapisan rocksalt digunakan untuk penyisipan F − sementara situs anion tambahan, yang dihasilkan melalui pembentukan ikatan O–O (yaitu, redoks oksigen) dalam lapisan perovskit memungkinkan tingkat penyisipan F⁻ yang lebih besar daripada yang diantisipasi hanya pada struktur kristal, sehingga menghasilkan kapasitas yang ditingkatkan secara signifikan. Selain itu, material tersebut menunjukkan perubahan volume yang dapat diabaikan ketika terjadi kelebihan penyisipan F − dengan pembentukan ikatan O–O ke dalam lapisan perovskit. Hasil ini menunjukkan bahwa jika pembentukan ikatan O–O dapat dimanfaatkan secara efektif dalam struktur perovskit dengan kekosongan anion dan bobot rumus kimia yang lebih kecil daripada La 1,2 Sr 1,8 Mn 2 O 7-δ F 2 oksifluorida, sejumlah besar penyisipan/ekstraksi F − (yaitu, kapasitas tinggi) dengan perubahan volume yang kecil dimungkinkan.
Berdasarkan konsep di atas, di sini, kami menerapkan SrFeO 2 , yang memiliki struktur lapisan tak terhingga yang terdiri dari kekosongan anion yang tersusun secara teratur, [ 11 ] sebagai bahan katode untuk semua FIB keadaan padat. Tidak seperti fluorinasi kimia yang mengakomodasi 1 F − per sel satuan berdasarkan model perovskit SrFeO 2 F, [ 12 ] F − berlebih yang mengejutkan sebesar ≈2,3 mol dalam SrFeO 2 dimasukkan melalui fluorinasi elektrokimia dengan redoks Fe 2+ /Fe 3+ dan pembentukan ikatan O–O (redoks oksigen), yang menyediakan kapasitas reversibel yang sangat tinggi sebesar 350 mAh g −1 dan 1843 mAh cm −3 . Khususnya, rasio perubahan volume selama F − (de)interkalasi hanya 0,5%, yang merupakan faktor kritis untuk stabilitas siklus sebagai katode dari semua FIB solid-state. Lebih jauh, serangkaian CaFeO 2 tersubstitusi Sr [ 13 ] diperiksa sebagai kandidat yang penuh harapan untuk mengejar kapasitas yang lebih tinggi dan menekan biaya sumber daya unsur, dan Ca 0,8 Sr 0,2 FeO 2 dapat menyediakan kapasitas reversibel yang sangat besar sebesar 580 mAh g −1 dan 2595 mAh cm −3 , yang sangat tinggi di antara semua katode yang dilaporkan untuk FIB. Kami percaya temuan ini dapat memberikan prinsip desain baru untuk katode dari semua FIB solid-state, serta membawa lebih banyak pertimbangan untuk mengembangkan senyawa anion campuran baru.
2 Hasil dan Pembahasan
2.1 Perilaku Penyisipan/Ekstraksi Ion Fluorida pada SrFeO2 Sebelum Aktivasi
SrFeO2 disintesis dengan mereduksi SrFeO3 yang telah disiapkan sebelumnya dengan CaH2 menurut penelitian sebelumnya. [ 11 ] Rincian prosedur sintesis dan karakterisasi dijelaskan dalam Bagian Eksperimen, Gambar S1 dan Tabel S1 (Informasi Pendukung). SrFeO2 yang telah disiapkan dicampur dengan elektrolit padat (La 0,9 Ba 0,1 F 2,9 ) dan Serat Karbon yang Ditumbuhkan dengan Vaper (VGCF) dengan penggilingan bola dalam rasio berat 30: 60: 10 seperti pada laporan sebelumnya. [ 9 ] Untuk mengevaluasi sifat elektrokimia katode SrFeO 2 , sel dua elektroda dirakit, di mana jumlah berlebih Pb/PbF 2 / La 0,9 Ba 0,1 F 2,9 / anoda VGCF untuk katode SrFeO 2 digunakan karena kinetika fluorinasi/defluorinasi PbF 2 yang cepat dan potensi redoks yang konstan dalam kandungan fluor yang luas. [ 14 ] Seperti yang ditunjukkan pada Gambar 1 a , katode SrFeO 2 menunjukkan kapasitas yang luar biasa sebesar 350 mAh g −1 dengan satu plateau tegangan pada 1,8 V pada pengisian pertama, dan kapasitas 251 mAh g −1 dengan plateau tegangan pada 0,5 dan −0,1 V pada pelepasan berikutnya. Kapasitas pengisian ireversibel pada siklus pertama mungkin berasal dari reaksi pelepasan oksigen parsial. [ 9 , 15 ] Khususnya setelah siklus awal, katode menunjukkan perilaku yang berbeda selama pengisian daya berikutnya, dengan kapasitas 290 mAh g⁻¹ dan plateau tegangan pada −0,5 dan 1,5 V, berbeda dengan siklus pertama (Gambar S2a , Informasi Pendukung). Kemudian, ia menghasilkan kapasitas pelepasan 271 mAh g −1 dengan plateau tegangan pada 0,5 dan −1,0 V, yang mirip dengan pelepasan pertama. Dalam siklus berikutnya, kapasitas meningkat secara bertahap, menunjukkan kurva pengisian/pengosongan yang sama seperti pada siklus kedua. Tegangan rata-rata pengisian/pengosongan selama lima siklus awal berubah sebagian besar hanya dari pengisian daya pertama ke pengisian daya kedua (Gambar S2b , Informasi Pendukung). Hasil ini menunjukkan bahwa struktur SrFeO 2 mengalami transformasi yang cukup besar selama pengisian daya pertama. Oleh karena itu, sangat penting untuk memantau perubahan struktur kristal dan elektronik untuk menjelaskan mekanisme reaksi.
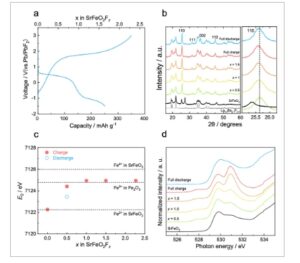
Gambar 1
Buka di penampil gambar
Kekuatan Gambar
Perubahan struktur kristal dan elektronik dari SrFeO 2 selama proses pengisian/pengosongan awal. a) Kurva pengisian/pengosongan selama siklus ke-1 dengan rapat arus 5 mA g −1 pada 140 °C. b) Pola XRD komposit katode yang mengandung SrFeO 2 sebelum dan setelah pengisian/pengosongan awal. Panjang gelombang sinar-X adalah 1,240 Å. Elektrolit padat La 0,9 Ba 0,1 F 2,9 ditampilkan sebagai referensi. Sisipan adalah tampilan XRD yang diperbesar ≈25,5°. c) Energi tepi serapan ( E 0 ) dari spektrum XAS tepi Fe K , d) Spektrum XAS tepi O K untuk berbagai keadaan dalam profil pengisian/pengosongan yang ditampilkan pada Gambar 1a . X pada gambar mewakili kandungan fluor ( x dalam SrFeO 2 F x ).
Perubahan struktur kristal dan elektronik selama pengisian dan pengosongan pertama diperiksa dengan difraksi sinar-X sinkrotron (XRD) dan spektroskopi serapan sinar-X (XAS) untuk Fe dan O K -edge. Dalam pola XRD (Gambar 1b ), semua puncak difraksi diindeks oleh SrFeO 2 dalam grup ruang P 4 /mmm dan elektrolit La 0,9 Ba 0,1 F 2,9 sebelum pengisian. Setelah pengisian ke x = 0,5, struktur kristal SrFeO 2 berubah menjadi struktur dengan grup ruangpersamaan matematika, yang sama dengan SrFeO 2 F yang diperoleh dengan fluorinasi kimia SrFeO 2 . [ 12 ] Posisi puncak bergeser ke sudut yang lebih rendah karena ekspansi kisi tetapi mempertahankan struktur kristal yang sama dalam pengisian berikutnya. Setelah pelepasan, meskipun posisi puncak bergeser ke sisi sudut yang lebih tinggi, struktur kristal SrFeO 2 F x tidak kembali ke yang murni yang dicirikan oleh grup ruang P 4 / mmm ; sebaliknya, ia bertahan dalam grup ruangpersamaan matematika. Dalam spektrum XAS tepi K Fe (Gambar 1c ; Gambar S3 , Informasi Pendukung), energi tepi serapan ( E 0 ) bergeser ke energi yang lebih tinggi pada tahap awal penyisipan F − ( x ≤ 1), tetapi kemudian tetap tidak berubah dalam penyisipan F − ( x > 1) berikutnya . E 0 sebagian kembali ke energi asli setelah pelepasan penuh. Dalam spektrum XAS tepi O K (Gambar 1d ), dua puncak, yang dikaitkan dengan transisi dari level O 1 s ke keadaan hibridisasi orbital Fe 3 d dan O 2 p , [ 16 ] diamati ≈530 eV sebelum pengisian (SrFeO 2 ). Intensitas ≈527,5 eV meningkat pada tahap awal penyisipan F − ( x ≤ 1), yang telah diamati pada bahan interkalasi berbasis besi lainnya dan akan dikaitkan dengan pembentukan spesies superoksida. [ 10 , 17 ] Di sisi lain, penyisipan F − lebih lanjut di luar x ≈1 mengakibatkan munculnya puncak baru ≈530,8 eV, yang mirip dengan perilaku redoks oksigen yang diamati pada katoda yang dilaporkan sebelumnya. [ 9 , 10 , 18 ] Kemudian, setelah pelepasan penuh, bentuk spektrum tidak kembali ke keadaan sebelum pengisian daya. Hasil ini menunjukkan bahwa struktur kristal SrFeO 2 berubah secara ireversibel dari struktur lapisan tak terbatas ( P 4 /mmm ) ke struktur perovskit SrFeO 2 F x (persamaan matematika) selama siklus pertama, dan bersamaan dengan itu struktur elektronik Fe dan O berubah secara ireversibel. Perbedaan mencolok dalam bentuk kurva pengisian/pengosongan antara siklus pertama dan kedua (Gambar 1a ) akan dikaitkan dengan perubahan ireversibel ini. Meskipun asal muasal yang tepat dari peningkatan bertahap dalam kapasitas pengisian/pengosongan selama beberapa siklus awal masih sulit dipahami, bentuk kurva pengisian/pengosongan yang konsisten menunjukkan bahwa (de)interkalasi elektrokimia F − ke dalam struktur perovskit SrFeO 2 F x sedang terjadi. Di sini, kami mempertimbangkan lima siklus awal dengan peningkatan kapasitas yang diamati sebagai proses aktivasi katode SrFeO 2 , sifat elektrokimia dan mekanisme reaksi katode SrFeO 2 F x setelah pelepasan penuh kelima (pada akhir proses aktivasi) akan diselidiki di bagian berikut.
2.2 Perilaku Penyisipan/Ekstraksi Ion Fluorida pada SrFeO 2 F x Setelah Aktivasi
SrFeO 2 F x setelah proses aktivasi menunjukkan sifat elektrokimia yang sangat baik. Seperti yang ditunjukkan pada Gambar 2a , SrFeO 2 F x menyediakan kapasitas 353 mAh g −1 , yang melebihi kapasitas untuk 1 F − yang sesuai dengan penyisipan 2,3 F − , dengan satu plateau ≈1,5 V dalam pengisian daya, dan kemudian menyediakan kapasitas 350 mAh g −1 dengan satu plateau dalam pengosongan daya. Kapasitas pengisian/pengosongan daya SrFeO 2 F x dipertahankan di atas 320 mAh g −1 tanpa peluruhan tegangan selama sedikitnya 30 siklus, dan efisiensi coulombik untuk setiap siklus mendekati 100% (Gambar 2b ; Gambar S4 , Informasi Pendukung). Lebih jauh lagi, SrFeO 2 F x menunjukkan kemampuan laju yang relatif tinggi (200 mAh g −1 pada 100 mA g −1 seperti yang ditunjukkan pada Gambar 2b ), yang sebanding dengan La 1,2 Sr 1,8 Mn 2 O 7−δ F 2 , [ 9 ] dan hasilnya menunjukkan difusi cepat F − dalam jumlah besar. Lebih jauh lagi, sel penuh menggunakan SrFeO 2 F x , Ca 0,5 Ba 0,5 F 2, dan La 2,9 Ba 0,1 F 2,9 sebagai katode, elektrolit padat, dan anoda, masing-masing, dievaluasi untuk kinerja elektrokimia (detail pada Gambar S5 dan S6 , Informasi Pendukung). Sel penuh menunjukkan kapasitas 310 mAh g −1 dengan tegangan rata-rata 2,8 V dan siklusabilitas yang baik. Berdasarkan bahan aktifnya, sel penuh menunjukkan kerapatan energi gravimetrik sebesar 495 Wh kg −1 dan kerapatan energi volumetrik sebesar 2736 Wh L −1 , melampaui sel LiCoO 2 /grafit konvensional (432 Wh kg −1 dan 1550 Wh L −1 ).
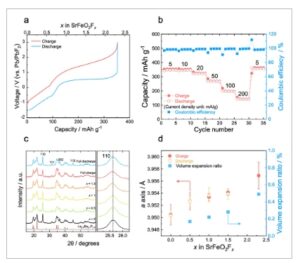
Gambar 2
Buka di penampil gambar
Kekuatan Gambar
Sifat elektrokimia dan perubahan struktur kristal SrFeO 2 F x setelah proses aktivasi. a) Kurva pengisian/pengosongan dengan rapat arus 5 mA g −1 pada 140 °C. b) Performa laju dan efisiensi coulombik dengan rapat arus berbeda antara 5 dan 200 mA g −1 pada 140 °C. c) Pola XRD komposit katode yang mengandung SrFeO 2 F x sebelum dan sesudah pengisian/pengosongan. Panjang gelombang sinar-X adalah 1,240 Å. Elektrolit padat La 0,9 Ba 0,1 F 2,9 ditampilkan sebagai referensi. Sisipan adalah tampilan XRD yang diperbesar ≈25,5°. X pada gambar mewakili kandungan fluor ( x dalam SrFeO 2 F x ). d) Konstanta kisi a dan rasio ekspansi volume SrFeO 2 F x sebelum dan sesudah pengisian/pengosongan.
Struktur kristal SrFeO 2 F x yang diaktifkan sebelum pengisian ( x = 0) memiliki grup ruangpersamaan matematikadengan konstanta kisi a = 3,9505 Å, yang sama dengan struktur kristal setelah pelepasan pertama SrFeO 2 yang tidak diaktifkan (Gambar 2c ). Pada pengisian berikutnya, puncak 110 dari SrFeO 2 F x bergeser terus menerus ke sudut yang lebih rendah dengan grup ruang yang sama, dan kemudian, setelah pelepasan, kembali ke keadaan yang sama seperti sebelum pengisian. Hasil ini menunjukkan perubahan reversibel dalam struktur kristal. Konstanta kisi yang dihitung dari pemasangan pola XRD melalui analisis Le Bail berubah secara reversibel dari 3,9505 Å menjadi 3,9569 Å dan rasio ekspansi volume kisi ~ 0,5% setelah F − (de)interkalasi (Gambar 2d ). Rasio ekspansi volume kisi ini sebanding dengan nilai Li 1,25 V 0,55 Nb 0,2 O 1,9 F 0,1 (0,7%), [ 19 ] yang dikenal sebagai elektroda interkalasi ion litium tanpa regangan, suatu keuntungan untuk mempertahankan kontak yang kuat di antarmuka katoda/elektrolit padat.
2.3 Mekanisme Kompensasi Muatan SrFeO 2 F x Setelah Aktivasi
Selanjutnya untuk mengungkap kelebihan mekanisme penyisipan F − dan kompensasi muatan (de)fluorinasi dalam SrFeO 2 F x diperiksa dengan XAS keras/lunak sinkrotron ( Gambar 3 a–c ; Gambar S7 , Informasi Pendukung). E 0 dari spektrum XAS Fe K -edge untuk SrFeO 2 F x selama pengisian dan pengosongan bergeser secara reversibel ke energi yang lebih tinggi dan lebih rendah dalam rentang x ≤ 1 dan berada di antara E 0 dari SrFeO 2 dan SrFeO 3 (Gambar 3a ), yang menunjukkan bahwa redoks Fe 2+ /Fe 3+ reversibel terjadi dalam rentang x ≤ 1. Dalam spektrum XAS O K -edge, puncak lebar diamati ≈530 eV sebelum pengisian ( x ≈0) dan intensitas ≈527,5 eV meningkat pada tahap awal penyisipan F − ( x ≤ 1) (Gambar 3b ). Penyisipan F − lebih lanjut di luar x ≈1 mengakibatkan munculnya puncak baru ≈530,8 eV, yang mirip dengan yang diamati pada siklus pertama, dan intensitas puncaknya meningkat dengan peningkatan x . Puncak ≈530,8 eV menghilang secara reversibel setelah ekstraksi F − berikutnya , berbeda dari siklus ke-1. Meningkatnya intensitas puncak baru di O K -edge XAS dan oksidasi besi yang tidak berubah selama 1 < x < 2 sangat menunjukkan bahwa spesies oksigen teroksidasi terlibat dalam kompensasi muatan, seperti yang diamati di katode yang dilaporkan sebelumnya. [ 9 , 10 , 18 ] Setelah penyisipan F − di luar x ≈1, wilayah pra-tepi ≈684,5 eV dari spektrum F K -edge XAS (Gambar 3c ) menunjukkan puncak kecil yang diidentifikasi sebagai ikatan logam-fluor. [ 20 ] Intensitas puncak meningkat dengan penyisipan F − dan puncak menghilang secara reversibel setelah ekstraksi F − berikutnya , yang menunjukkan pembentukan ikatan Fe-F yang reversibel dalam struktur. Pada kepadatan parsial keadaan (pDOS) untuk SrFeO 2 F, yang telah dilaporkan sebelumnya, [ 21 ] hanya orbital Fe 3 d dan O 2 p yang ada di dekat tingkat Fermi, dengan F 2 ppada energi yang jauh lebih rendah dibandingkan dengan orbital-orbital ini. Hasil-hasil ini menunjukkan bahwa sulit bagi sebuah lubang untuk terbentuk di orbital F 2 p ketika kelebihan F − dimasukkan ke dalam katode. Hasil-hasil XAS tepi F K dan pDOS yang serupa telah dilaporkan di katode La 1,2 Sr 1,8 Mn 2 O 7-δ F 2 . [ 9 ] Oleh karena itu, perubahan daerah pra-tepi di XAS tepi F K mungkin disebabkan oleh pembentukan sebuah lubang di orbital O 2 p , yang mengubah orbital 3 d dari Fe yang berdekatan, yang pada gilirannya mengubah orbital F 2 p yang berdekatan dengan Fe. Untuk menganalisis lebih lanjut sifat spesies oksigen teroksidasi selama penyisipan F − , pengukuran hamburan sinar-X inelastis resonansi (RIXS) dari 527,9 hingga 533,0 eV dalam spektrum XAS tepi O K dilakukan (Gambar 3d ; Gambar S8 , Informasi Pendukung). Spektrum RIXS yang diperoleh dari SrFeO 2 F x yang bermuatan penuh pada 530,8 eV menunjukkan puncak kehilangan energi diskret di sekitar garis elastis dari 2 hingga 0 eV, yang mewakili beberapa tingkat vibrasi permukaan energi potensial keadaan dasar. [ 22 ] Frekuensi tingkat vibrasi pertama adalah ≈1600 cm −1 dan ini menunjukkan bahwa penambahan penyisipan F − mengarah pada pembentukan ikatan O–O, mirip dengan molekul O 2 , yang telah diamati dalam bahan katode bermuatan lainnya dan elektrokatalis perovskit oleh RIXS. [ 9 , 10 , 18 , 23 ] Getaran ini menghilang setelah pelepasan penuh. Dalam bahan katode LIB, baru-baru ini dilaporkan bahwa molekul O 2 terbentuk karena efek pengukuran RIXS pada spesies M–O–O (M: logam transisi) yang terbentuk selama pengisian daya dalam struktur kristal. [ 24 ] Hal ini menunjukkan bahwa perlu untuk membahas pembentukan ikatan OO dalam sampel ini menggunakan pengukuran selain RIXS. Untuk memeriksa lebih lanjut keberadaan pembentukan ikatan O–O, analisis fungsi distribusi pasangan (PDF) menggunakan sinar-X sinkrotron energi tinggi dilakukan pada SrFeO 2 selama pengisian pertama (Gambar S9 , Informasi Pendukung). Di wilayah 0–3 Å dari pola PDF yang diperoleh, puncak ≈1,9 Å dan puncak ≈2,6 Å diamati dalam SrFeO 2 murni.(murni). Puncak-puncak ini dikaitkan dengan ikatan Fe–O (1,9 Å) dan Sr–O (2,6 Å), berturut-turut. Dalam SrFeO 2 F, di mana 1F − dimasukkan ke dalam SrFeO 2 , intensitas puncak yang dikaitkan dengan ikatan Fe–O ≈1,9 Å relatif berkurang karena jumlah besar elektrolit padat La 0,9 Ba 0,1 F 2,9 dalam komposit katode, dan puncak ikatan La–F dari elektrolit padat La 0,9 Ba 0,1 F 2,9 diamati ≈2,6 Å, yang tumpang tindih dengan puncak ikatan Sr–O. Mirip dengan SrFeO 2 F, dalam SrFeO 2 bermuatan penuh (Muatan penuh), puncak yang dikaitkan dengan ikatan Fe–O dan puncak yang dikaitkan dengan ikatan Sr–O dan La–F diamati ≈1,9 dan 2,6 Å, berturut-turut. Akan tetapi, sebagai tambahan pada puncak-puncak ini, puncak baru diamati ≈1,2 Å, yang jarak antar atomnya sangat sesuai dengan jarak ikatan O–O. Puncak serupa juga diamati dalam analisis PDF difraksi neutron dari Li 1,2 Ni 0,13 Co 0,13 Mn 0,54 O 2 setelah pengisian daya. [ 25 ] Hasil analisis PDF mendukung pembentukan ikatan O–O dalam SrFeO 2 F x yang bermuatan penuh . Akan tetapi, belum jelas pada titik ini apakah doping hole ke orbital p O 2 akan mengarah pada pembentukan ikatan OO kuantitatif, dan evaluasi hubungan kuantitatif antara jumlah spesies O 2 dan kompensasi muatan merupakan masalah untuk masa mendatang, termasuk penetapan metode analitis (lihat catatan suplemen dengan Gambar S10 – S12 , Informasi Pendukung). Hasil ini menunjukkan bahwa pembentukan ikatan molekul O–O terjadi pada SrFeO 2 F x selama proses pengisian selanjutnya ( x > 1) dan pembentukan/pemutusan ikatan O–O bersifat reversibel, seperti yang diamati pada La 1,2 Sr 1,8 Mn 2 O 7–δ F 2 yang bermuatan . [ 9 ]
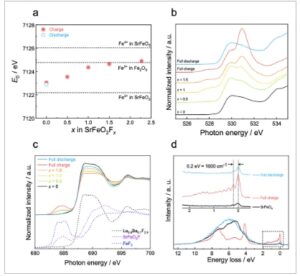
Gambar 3
Buka di penampil gambar
Kekuatan Gambar
Perubahan struktur elektronik untuk SrFeO 2 F x setelah proses aktivasi pada proses pengisian/pengosongan. a) Energi tepi serapan ( E 0 ) dari spektrum XAS tepi Fe K , b) spektrum XAS tepi O K , c) spektrum XAS tepi F K , untuk berbagai keadaan dalam profil pengisian/pengosongan yang ditunjukkan pada Gambar 2a . X pada gambar mewakili kandungan fluor ( x dalam SrFeO 2 F x setelah proses aktivasi). d) Spektrum RIXS resolusi tinggi yang direkam pada energi eksitasi pada 530,8 eV untuk dalam SrFeO 2 , SrFeO 2 F x yang terisi penuh dan terisi penuh setelah proses aktivasi.
SrFeO 2 F x dapat memfasilitasi penyisipan/ekstraksi F − berlebih dengan ekspansi volume kecil, mempertahankan struktur perovskitnya. Karena jumlah F − yang dapat ditampung dalam kekosongan anion reguler bahkan untuk SrFeO 2 per unit rumus adalah 1, memerlukan keberadaan situs anion tambahan di SrFeO 2 F x untuk menampung lebih dari 1 F − . Pembentukan ikatan O–O di SrFeO 2 F x selama proses pengisian selanjutnya ( x > 1) dapat berfungsi ganda: tidak hanya berkontribusi pada kompensasi muatan tetapi juga menciptakan situs anion tambahan untuk menampung kelebihan F − . Namun, dengan asumsi O 2 netral mengkompensasi muatan penyisipan F − berlebih (1,3 e − ), kekosongan anion yang dibuat adalah ≈0,33 dan sejumlah besar F − harus ditampung di situs tidak teratur lebih lanjut. Teknik titrasi galvanostatik intermiten (Gambar S13 , Informasi Pendukung) menunjukkan bahwa polarisasi dan histeresis tegangan rangkaian terbuka lebih besar untuk x > 1 daripada 0 < x ≤ 1, dan polarisasi yang lebih besar untuk x > 1 mungkin disebabkan oleh pengurangan konduktivitas elektronik dengan penyisipan F − berlebih atau distorsi lokal dengan pembentukan O–O. Telah dilaporkan bahwa polarisasi besar serupa telah diamati pada bahan katode lainnya [ 9 ] dan bahwa pembentukan ikatan O–O dengan distorsi lokal pada potensial tinggi terjadi pada elektrokatalis perovskit. [ 23 ] Perubahan volume kecil selama pengisian dalam SrFeO 2 F x dapat menunjukkan bahwa F − disisipkan ke dalam situs perkolasi acak dalam struktur perovskit. Ekspansi volume kecil serupa telah dilaporkan dalam penyisipan dan ekstraksi ion litium ke dalam situs perkolasi acak dalam struktur batuan garam yang tidak teratur seperti oksida Li 1,25 Nb 0,25 V 0,5 O 2 (1%) [ 26 ] dan Li 1,25 V 0,55 Nb 0,2 O 1,9 F 0,1 (0,7%). [ 19 ] Meskipun bagaimana ikatan O–O dan kelebihan F − hadir dalam SrFeO 2 F x bermuatantidak jelas; hasil ini menunjukkan bahwa ikatan O–O dan kelebihan F − mungkin ada di beberapa rongga dalam struktur perovskit, seperti yang dilaporkan pada katode La 1.2 Sr 1.8 Mn 2 O 7–δ F 2 . [ 9 ]
2.4 Penyisipan/Ekstraksi Ion Fluorida pada CaFeO2 yang Disubstitusi Sr
Meskipun kapasitas reversibel terpuji yang ditunjukkan oleh SrFeO₂F x , yang menggunakan penyisipan F − berlebih dengan redoks Fe 2+ /Fe 3+ dan pembentukan ikatan O–O (redoks oksigen), berat atom strontium (Sr) yang relatif tinggi menimbulkan keterbatasan pada kapasitas keseluruhan material. Dalam upaya meningkatkan kapasitas material katode SrFeO 2 F x , Sr digantikan dengan berat atom yang lebih rendah dan Ca yang melimpah di bumi (Tabel S2 , Informasi Pendukung). Serangkaian senyawa Ca y Sr 1- y FeO 2 ( y = 0,2, 0,4, 0,7, 0,8, dan 1,0) [ 13 ] disintesis dan diaplikasikan pada material katode untuk FIB serba-padat. Rincian prosedur sintesis dan karakterisasi dijelaskan dalam Bagian Eksperimen, Gambar S14 – dan S15 dan Tabel S3 – S7 (Informasi Pendukung). Pola XRD Ca y Sr 1- y FeO 2 ( y = 0,2, 0,4, 0,7, dan 0,8) diindeks ke grup ruang yang sama dari P 4 / mmm seperti SrFeO 2 (Gambar S16a , Informasi Pendukung) dan konstanta kisi Ca y Sr 1- y FeO 2 menurun dengan peningkatan kandungan Ca. Di sisi lain, CaFeO 2 ( y = 1), menunjukkan simetri yang lebih rendah,mathematical equation, karena distorsi persegi planar [FeO 4 ] (Gambar S16b , Informasi Pendukung). Hasil ini sesuai dengan laporan sebelumnya. [ 13 ] Ca y Sr 1- y FeO 2 F x setelah proses aktivasi menunjukkan kurva pengisian/pengosongan yang mirip dengan SrFeO 2 F x ( Gambar 4 a ). Perlu dicatat bahwa Ca 0,8 Sr 0,2 FeO 2 F x menunjukkan kapasitas sangat tinggi sebesar 580 mAh g −1 (2595 mAh cm −3 ). Perhatikan bahwa kapasitas tertinggi di antara keduanya tidak diperoleh dalam CaFeO 2 F x tetapi dalam Ca 0,8 Sr 0,2 FeO 2 F x , yang mungkin disebabkan oleh struktur kristal CaFeO 2 yang terdistorsi dan tidak diinginkan . XAS O, F, Fe K -edge membuktikan bahwa redoks Fe 2+ /Fe 3+ bertanggung jawab atas kompensasi muatan dalam rentang x ≤ 1,0 dan redoks oksigen dalam rentang x > 1,0 untuk penyisipan/ekstraksi F − dalam Ca 0,8 Sr 0,2 FeO 2 F x , yang merupakan mekanisme yang sama dengan SrFeO 2 F x (Gambar S17 , Informasi Pendukung).
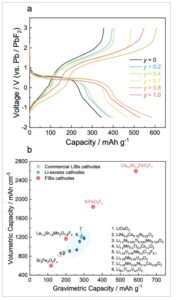
Gambar 4
Buka di penampil gambar
Kekuatan Gambar
Sifat elektrokimia Ca y Sr 1- y FeO 2 F x ( y = 0, 0,2, 0,4, 0,7, 0,8, dan 1,0) setelah proses aktivasi. a) Kapasitas pelepasan Ca y Sr 1- y FeO 2 F x ( y = 0, 0,2, 0,4, 0,7, 0,8, dan 1,0) dengan rapat arus 5 mA g −1 pada suhu 140 °C. b) Perbandingan kapasitas volumetrik/gravimetrik untuk oksidafluorida SrFeO 2 F x dan Ca 0,8 Sr 0,2 FeO 2 F x serta material katode dalam LIB dan FIB. [ 7 , 9 , 19 , 26 , 27 ]
SrFeO 2 F x dan Ca 0,8 Sr 0,2 FeO 2 F x menunjukkan kapasitas gravimetrik dan volumetrik yang lebih tinggi daripada katode sebelumnya dalam LIB dan FIB dengan menggunakan penyisipan/ekstraksi F − berlebih dengan redoks Fe 2+ /Fe 3+ dan redoks oksigen (Gambar 4b ). [ 7 , 9 , 19 , 26 , 27 ] Khususnya, Ca 0,8 Sr 0,2 FeO 2 F x menyediakan kapasitas hampir tiga kali lebih tinggi daripada katode LIB yang dikomersialkan, yang terutama terdiri dari unsur-unsur yang melimpah seperti kalsium, besi, dan oksigen, sehingga membuatnya sangat menarik untuk aplikasi praktis skala besar. Prototipe FIB yang dibangun dengan katode Ca 0,8 Sr 0,2 FeO 2 F x /anode LaF 3 dapat memberikan kerapatan energi volumetrik yang besar (3392 Wh L −1 ), yang 2,4 kali lebih tinggi daripada sel LiCoO 2 /grafit konvensional (1550 Wh L −1 ), berdasarkan material aktif (Tabel S8 , Informasi Pendukung). Sangat penting untuk menekankan bahwa FIB memiliki ruang yang signifikan untuk perbaikan lebih lanjut dalam hal sifat elektrokimia seperti stabilitas siklus, karakteristik laju, yang strateginya mencakup pengendalian komposisi kimia material aktif, jalur ionik/elektronik dalam elektroda komposit, dan kontak antarmuka antara elektroda dan elektrolit. Lebih jauh lagi, mekanisme yang mendasari keberadaan ikatan O–O dan kelebihan F⁻ dalam oksifluorida perovskit masih belum dijelaskan secara memadai. Memahami mekanisme ini sangat penting untuk merancang katoda yang baik, secara umum, senyawa anion campuran [ 28 ] yang memiliki berbagai fungsi fisik dan kimia dan oleh karena itu hal ini harus diperjelas di masa depan.
3 Kesimpulan
Dalam studi ini, kami menunjukkan F − (de)interkalasi elektrokimia dalam senyawa SrFeO 2 dan CaFeO 2 tersubstitusi Sr dengan struktur lapisan tak terhingga yang terdiri dari kekosongan anion yang tersusun teratur sebagai bahan katode untuk FIB serba-padat. Oksifluoride perovskit SrFeO 2 F x , yang diperoleh dari SrFeO 2 melalui proses aktivasi, memberikan kapasitas reversibel yang sangat tinggi sebesar 350 mAh g −1 dan 1843 mAh cm −3 , dan kinerja siklus dan laju yang baik. Kapasitas tinggi dicapai dengan kelebihan F − (de)interkalasi sebesar ≈2,3 mol dalam SrFeO 2 F x dengan redoks Fe 2+ /Fe 3+ dan redoks oksigen. Menariknya, rasio perubahan volume SrFeO2Fx selama F− ( de )interkalasi hanya 0,5%, yang merupakan keuntungan untuk mempertahankan kontak yang kuat pada antarmuka katode/elektrolit padat. Lebih jauh, CaFeO2Fx tersubstitusi Sr ( Ca0,8Sr0,2FeO2Fx ) memberikan kapasitas reversibel yang sangat besar sebesar 580 mAhg −1 dan 2595 mAhcm −3 , dan prototipe FIB yang dibangun oleh katode Ca0,8Sr0,2FeO2Fx /anode LaF3 , dapat memberikan kerapatan energi volumetrik yang sangat besar (3392 WhL − 1 ) berdasarkan material aktif . Pembentukan ikatan OO dalam material katode dikonfirmasi menggunakan analisis RIXS dan PDF, tetapi klarifikasi lebih rinci diperlukan mengenai kontribusi kuantitatif pembentukan ikatan OO terhadap kapasitas muatan. Penelitian ini akan memberikan prinsip desain baru untuk pengembangan bahan katoda FIB serba-padat dan pengembangan senyawa anion campuran baru.
4 Bagian Eksperimen
Sintesis Bahan
Ca y Sr 1‒y FeO 2 (y = 0, 0,2, 0,4, 0,7, 0,8, 1) disiapkan dengan menggunakan reaksi keadaan padat konvensional yang mirip dengan yang dijelaskan sebelumnya. [ 13 ] Prekursor Ca y Sr 1‒y FeO 3 disintesis dari CaCO 3 (99,99%, Kojundo Chemical Laboratory), SrCO 3 (99,99%, Kojundo Chemical Laboratory), dan Fe 2 O 3 (99,9%, WAKO pure chemical industries, ltd.) di udara dengan reaksi keadaan padat. CaCO 3 dikeringkan terlebih dahulu sebelum digunakan, kemudian tiga bahan dicampur dalam rasio stoikiometris, dipeletkan, dan disinter pada 1200 °C selama 72 jam dalam tiga kali; pelet dihancurkan pada akhir setiap periode sintering 24 jam dan ditekan ulang. Untuk memperoleh senyawa Ca y Sr 1‒y FeO 2 , prekursor dicampur secara homogen dengan kelebihan 2 mol CaH 2 (99,99%, Sigma–Aldrich), ditekan, dan disegel dalam tabung Pyrex yang dievakuasi dalam glovebox berisi argon. Tabung vakum kemudian disinter pada suhu 280 °C. Akhirnya, produk dicuci tiga kali dengan larutan NH 4 Cl/metanol 0,15 m untuk menghilangkan sisa CaH 2 dan produk sampingan CaO. Elektrolit padat La 0,9 Ba 0,1 F 2,9 disintesis seperti yang dilaporkan dalam literatur. [ 29 ] LaF3 (99,9%, Laboratorium Kimia Kojundo) dan BaF2 ( 99,9 %, Laboratorium Kimia Kojundo) dicampur dalam rasio molar 9:1 dan digiling bola pada 600 rpm selama 12 jam menggunakan pot ZrO2 45 mL berisi Ar dan bola Φ5 mm. Campuran tersebut dianil pada 600 °C selama 10 jam dalam atmosfer Ar. Ca0,5Ba0,5F2 disiapkan dengan metode penggilingan bola, [ 30 ] di mana rasio stoikiometri BaF2 dan CaF2 dicampur selama 99 jam pada 600 rpm menggunakan pot ZrO2 45 mL berisi Ar dan bola Φ5 mm.
Perakitan Sel Elektrokimia Tipe Padat Penuh dan Pengukuran Elektrokimia
Komposit katode terdiri dari bubuk Ca 1–y Sr y FeO 2 , bubuk La 0,9 Ba 0,1 F 2,9 dan Serat Karbon yang Ditumbuhkan dengan Uap (Showa Denko, VGCF, kualitas baterai), yang dicampur dalam rasio berat 30:60:10 dengan penggilingan bola selama 10 jam pada 100 rpm menggunakan 45 mL pot ZrO 2 dan bola ZrO 2 . La 0,9 Ba 0,1 F 2,9 digunakan sebagai elektrolit padat. Komposit anoda, PbF2 ( 99,9%, Kojundo Chemical Laboratory Co., Ltd.), bubuk Pb (99,9% Kojundo Chemical Laboratory Co. Ltd.), La 0,9 Ba 0,1 F 2,9 dan VGCF pertama-tama dicampur dalam mortar dengan perbandingan berat 3:2:4:1, kemudian campuran tersebut dipindahkan ke dalam pot ball mill ZrO2 , kemudian diproduksi dengan ball milling pada 100 rpm selama 12 jam. Sel elektrokimia dirakit dalam pelet berbentuk cakram dengan lapisan katode/elektrolit padat/anode yang dikompresi. Komposit katode dan La 0,9 Ba 0,1 F 2,9 dikompresi di bawah 360 MPa. Kemudian, komposit anoda ditambahkan sebagai lapisan anoda dan foil Au ditambahkan pada kedua sisi sebagai pengumpul arus. Lapisan-lapisan ini dikompresi di bawah 360 MPa. Diameter pelet adalah 10 mm. Semua proses fabrikasi sel elektrokimia tipe padat dilakukan di bawah atmosfer Ar dalam glovebox. Sel yang telah dirakit dimasukkan ke dalam wadah tertutup tanpa terpapar atmosfer udara. Eksperimen pengisian dan pengosongan sel ion fluorida padat dilakukan dalam rentang tegangan -1,5–3,0 V versus Pb/PbF 2 pada 140 °C dengan rapat arus 5 mA g -1 kecuali dinyatakan lain. Kinerja laju profil pengisian-pengosongan diukur dengan berbagai rapat arus pada proses pengisian dan pengosongan. Untuk perakitan sel penuh, komposit SrFeO 2 /La 0,9 Ba 0,1 F 2,9 /VGCF yang disebutkan di atas digunakan sebagai katode, dan Ca 0,5 Ba 0,5 F 2 digunakan sebagai elektrolit padat. Anoda terdiri dari La 0,9 Ba 0,1 F 2,9 dan lembaran logam lantanum yang dipoles. Sel dikompresi pada 360 MPa. Pengukuran pengisian-pengosongan sel penuh dilakukan dalam rentang tegangan 1–5,5 V (vs La/LaF 3 ) dengan laju arus 10 mA g −1pada suhu 140 °C. Sifat elektrokimia sel uji elektrokimia dikumpulkan menggunakan peralatan galvanostat (HJ1010SD8, Hokuto Denko Corporation).
Karakterisasi Material
Data difraksi serbuk sinar-X resolusi tinggi dikumpulkan pada suhu ruangan dalam atmosfer Ar, pada garis sinar BL02B2 dan BL19B2 di SPring-8 (Hyogo, Jepang). Sampel serbuk tanpa pengukuran elektrokimia dilakukan pada garis sinar BL02B2, di mana difraktometer dilengkapi dengan enam detektor penghitung foton mikrostrip silikon MYTHEN (Dectris Ltd., Baden, Swiss). Pengukuran dilakukan dalam geometri transmisi Debye-Scherrer menggunakan sinar-X dengan panjang gelombang 0,4133 Å. Sampel pelet dengan pengukuran elektrokimia dilakukan pada garis sinar BL19B2 menggunakan difraktometer multi-sumbu Huber dengan penghitung sintilasi. Pengukuran dilakukan dalam geometri Bragg-Brentano menggunakan sinar-X dengan panjang gelombang 1,240 Å. Data difraksi serbuk sinar-X untuk analisis fungsi distribusi berpasangan sampel serbuk sebelum dan sesudah pengukuran elektrokimia dikumpulkan pada suhu ruangan dalam atmosfer Ar, pada garis sinar BL02B2 dan BL19B2. Pengukuran dilakukan dalam geometri transmisi Debye-Scherrer menggunakan pelat pencitraan dan sinar-X dengan panjang gelombang 0,4149 Å pada BL02B2 dan 0,4137 Å pada BL02B2.
Gambar mikroskop elektron pemindaian (SEM) dan pemetaan spektroskopi sinar-X dispersif energi (EDX) diperoleh menggunakan mikroskop elektron pemindaian emisi medan S-3400N (Hitachi, Jepang).
Spektrum serapan sinar-X untuk Fe K -edge diperoleh dalam mode transmisi/fluoresensi menggunakan monokromator kristal ganda Si(111) pada BL14B2 di SPring-8. Sampel difiksasi dalam sel laminasi yang diisi dengan Ar. Spektrum serapan sinar-X untuk O dan F K -edge diperoleh dalam mode fluoresensi menggunakan kisi bidang dengan jarak garis bervariasi sebagai monokromator dengan cermin Au di cabang C BL27SU di SPring-8. Pengukuran dilakukan dalam vakum dan sampel dipindahkan dari glovebox berisi Ar tanpa paparan udara. Pengukuran hamburan sinar-X inelastis resonansi (RIXS) dilakukan di BL07LSU di SPring-8 menggunakan spektrometer emisi sinar-X lunak resolusi tinggi tipe grazing flat-field. [ 31 ] Resolusi energi total dari spektrum RIXSmathematical equationadalah ≈150 meV, ditentukan dengan mencocokkan hamburan elastis dari pelat Cu. Resolusi energi foton insiden ΔE hv adalah ≈100 meV, sehingga resolusi energi penganalisis emisi sinar-X lunak pada 530 eV ΔE ana diperkirakan sebesar ≈110 meV. Energi kehilangan RIXS dikalibrasi sebagai berikut. Pertama, energi sinar-X insiden ditetapkan pada 530 dan 520 eV, puncak elastis dari pelat Cu pada kedua energi diukur, dan energi emisi setiap puncak elastis ditentukan sebesar 530 dan 520 eV, berturut-turut. Skala antara kedua puncak tersebut kemudian dihitung dengan fungsi kuadrat yang diturunkan dari desain optik, dan persamaan konversi dari posisi pada detektor ke energi emisi diperoleh. Seperti halnya akurasi energi foton garis sinar, akurasi energi emisi absolut sekitar ±0,2 eV, tetapi akurasi relatif berada dalam kisaran ±0,5%. Di sini, kehilangan energi dalam RIXS adalah perbedaan energi dari hamburan elastis, yang berarti bahwa akurasi kehilangan energi berada dalam kisaran ±0,5%. Serbuk sampel ditopang pada pita karbon di kotak sarung tangan yang diisi dengan gas Ar dan dipindahkan ke ruang pengukuran tanpa terpapar atmosfer. Posisi sampel diubah pada 2,4 µm s −1 selama pengukuran RIXS untuk menghindari kerusakan radiasi.

