
Abstrak
Agar layak secara komersial, elektrolit untuk baterai logam litium (LMB) harus memungkinkan siklus hidup yang panjang dan karakteristik pengisian cepat dalam kondisi ekstrem (beban katode tinggi, rasio negatif/positif rendah, dan rasio elektrolit/katode rendah). Sementara elektrolit berbasis LiFSI biasanya menyediakan LMB dengan siklus hidup yang panjang, elektrolit tersebut sering kali kurang dalam hal kinetika. Studi ini, untuk pertama kalinya, menunjukkan bahwa elektrolit berbasis LiNO3 dapat secara bersamaan mencapai reversibilitas yang sangat baik dan kinetika yang cepat dalam LMB, mengungguli elektrolit berbasis LiFSI yang canggih. Khususnya, LiNi 0,8 Co 0,1 Mn 0,1 O 2 (NCM811) || Baterai Li menunjukkan retensi kapasitas 80% setelah 430 siklus, bersama dengan kinerja laju yang luar biasa (2,35 mAh cm⁻ 2 pada 12 mA cm −2 ) dalam kondisi praktis (20 mg cm −2 NCM811, foil Li 50 µm, dan elektrolit Ah⁻¹ 5,6 mL). Kinetika cepat dapat dikaitkan dengan pengangkutan ion litium yang efisien melalui elektrolit massal dan antarmuka elektroda/elektrolit. Penelitian ini menyoroti pentingnya garam LiNO 3 berbiaya rendah dan menyajikan jalur alternatif untuk mencapai kinerja yang unggul bagi baterai logam litium dalam kondisi ekstrem.
1 Pendahuluan
Kepadatan energi yang lebih tinggi tetap menjadi tujuan utama untuk baterai isi ulang yang canggih, terutama untuk elektronik portabel dan kendaraan listrik. [ 1 ] Baterai lithium-ion komersial saat ini, berdasarkan mekanisme interkalasi, menawarkan siklus hidup yang panjang (retensi kapasitas 80% setelah 1000 siklus). [ 2 ] Namun, kepadatan energinya (≈250 Wh kg −1 ) relatif rendah dan tidak sepenuhnya memuaskan. [ 3 ] Mengganti grafit dengan lithium metalik sebagai bahan anoda dapat meningkatkan kapasitas teoritis dari 372 menjadi 3860 mAh g −1 , yang secara signifikan meningkatkan kepadatan energi baterai. Selain itu, anoda logam lithium memiliki tegangan kerja terendah (−3,04 V vs. elektroda hidrogen standar), yang dapat memaksimalkan kepadatan energi di sisi anoda. [ 4 ] Meskipun demikian, pembentukan dendrit dapat menyebabkan korsleting, yang akan menyebabkan kebakaran dan ledakan. Lebih jauh lagi, reversibilitas yang buruk dari anoda logam lithium menghasilkan siklus hidup yang lebih pendek. [ 5 ]
Rekayasa elektrolit adalah pendekatan yang paling mudah dan mudah diakses untuk mengatasi tantangan ini. [ 6 ] Siklus hidup baterai logam litium (LMB) telah diperpanjang secara signifikan melalui penggunaan elektrolit canggih, seperti elektrolit konsentrasi tinggi yang terlokalisasi [ 7 ] dan elektrolit terfluorinasi. [ 8 ] Namun, sebagian besar penelitian ini terutama berfokus pada perpanjangan siklus hidup, sering kali mengabaikan kinerja laju dan kinetika, [ 9 ] terutama dalam kondisi praktis (beban massa katode tinggi, rasio negatif/positif rendah, dan rasio elektrolit/katode rendah). Tidak seperti beban massa katode rendah (<5 mg cm −2 ) yang biasanya digunakan di laboratorium, polarisasi menjadi lebih jelas pada rapat arus tinggi ketika beban massa mencapai tingkat industri komersial (≈20 mg cm −2 ). [ 10 ] Oleh karena itu, mencapai siklus hidup yang panjang dan kinetika yang cepat sangat penting untuk mengomersialkan LMB secara sukses.
LiFSI telah banyak digunakan sebagai garam untuk LMB, menunjukkan kinerja elektrokimia yang luar biasa. [ 11 ] Namun, untuk mencapai hasil yang optimal, LiFSI sering dikombinasikan dengan pelarut terfluorinasi. [ 8 , 12 ] Biaya tinggi dan masalah lingkungan yang terkait dengan pelarut terfluorinasi ini membatasi komersialisasi LMB dengan elektrolit berbasis LiFSI. [ 13 ] Litium nitrat (LiNO 3 ), yang telah lama dikenal sebagai aditif elektrolit yang sangat baik, [ 14 ] telah muncul sebagai garam utama yang layak untuk LMB karena efektivitas biaya dan kemampuannya untuk menekan pembentukan dendrit. [ 15 ] Baru-baru ini, kami menunjukkan bahwa menggunakan LiNO 3 sebagai satu-satunya garam, baterai NCM811 (20 mg cm −2 ) || Li (50 µm) dapat menunjukkan siklus hidup sedang (retensi kapasitas 80% setelah 170 siklus). [ 15 ] Namun, mencapai reversibilitas yang baik dan kinetika yang cepat tetap menjadi tantangan. Mengoptimalkan stabilitas siklus dan kinerja laju secara bersamaan dalam LMB terus menjadi masalah bagi elektrolit berbasis LiNO3 .
Dalam studi ini, kami berhasil mengaktifkan baterai NCM811 || Li untuk mencapai siklus hidup yang panjang dan kinerja laju yang baik dengan elektrolit berbasis LiNO 3 – dalam kondisi praktis (beban massa katode tinggi, rasio negatif/positif rendah, elektrolit ramping). Sebagai garam primer, LiNO 3 sangat reaktif dan mudah direduksi untuk membentuk antarmuka elektrolit padat (SEI) yang didominasi Li 2 O-Li 3 N, yang memfasilitasi difusi Li⁺ yang cepat melalui antarmuka. Dan difusi Li⁺ yang lambat dalam elektrolit massal yang mengandung LiNO 3 murni sebagai satu-satunya garam dapat ditingkatkan secara signifikan dengan penambahan co-garam yang sangat larut. Efisiensi coulombik sel Li || Cu dengan elektrolit berbasis LiNO 3 – adalah 99,38%, dan menunjukkan kelebihan potensial yang jauh lebih rendah untuk sel Li || Li dalam kepadatan arus tinggi. Selain itu, NCM811 (20 mg cm −2 ) || Baterai Li (50 µm) menunjukkan siklus hidup yang panjang (retensi kapasitas 80% setelah 430 siklus) bahkan dengan elektrolit yang rendah (5,6 mL Ah −1 ). Baterai ini juga mempertahankan kapasitas tinggi pada kepadatan arus yang tinggi (2,35 mAh cm −2 pada 12 mA cm −2 ). Penelitian ini menunjukkan bahwa elektrolit berbasis LiNO 3 berbiaya rendah dapat mengungguli elektrolit berbasis LiFSI untuk LMB dalam hal siklus hidup dan kinetika.
2 Struktur Pelarutan Elektrolit
Litium nitrat telah lama dikenal sebagai aditif yang efektif untuk baterai litium-sulfur. [ 14 ] Baru-baru ini, kami berhasil menggunakan LiNO 3 sebagai satu-satunya garam dalam baterai logam litium. Khususnya, baterai NCM811 (20 mg cm −2 ) || Li (50 µm) yang menggunakan elektrolit berbasis LiNO 3 kami menunjukkan siklus hidup sedang, mempertahankan 80% kapasitasnya setelah 170 siklus. LiNO 3 stabil secara termal hingga 600 °C dan tidak menghasilkan HF, tidak seperti LiPF 6 . Meskipun merupakan oksidator, ia banyak digunakan dalam formulasi tingkat baterai dan memiliki masalah mudah terbakar yang lebih rendah daripada sistem terfluorinasi. [ 15 ] Namun, mencapai siklus hidup yang panjang dan kinetika yang cepat secara bersamaan tetap menjadi tantangan yang signifikan. [ 15 ] Untuk meningkatkan kinetika, sangat penting untuk mempertimbangkan dengan cermat transportasi ion dalam elektrolit massal serta difusi melintasi antarmuka elektroda/elektrolit. Elektrolit yang hanya mengandung 1 M LiNO3 sebagai garamnya biasanya menunjukkan konduktivitas ionik rendah dan transpor ion lambat. [ 15 ] Untuk mengatasi hal ini, kami memperkenalkan litium difluoro(oksalat)borat (LiDFOB) sebagai co-garam, dipilih karena disosiasi pasangan ionnya yang tinggi dan mobilitas ion yang unggul. [ 13 , 16 ] Dengan mempertimbangkan keseimbangan antara konduktivitas ionik dan viskositas, konsentrasi LiDFOB dioptimalkan pada 0,75 (Tabel S1 , Informasi Pendukung). Selain itu, untuk transpor ion cepat, viskositas elektrolit rendah sangat penting. [ 17 ] Dimetoksietana (DME) dipilih sebagai pelarut utama karena viskositasnya yang rendah (0,46 cP pada 25 °C), sedangkan vinilena karbonat (VC) dipilih sebagai co-pelarut karena kemampuannya membentuk film pada anoda logam litium dan katoda NCM811. [ 18 ] Formulasi elektrolit (disingkat NDDV) dirancang untuk mengatasi transportasi ion massal dan stabilitas antarmuka secara sinergis. Formulasi ini terdiri dari: 1 M LiNO 3 sebagai garam primer, dipilih karena kemampuannya membentuk SEI kaya Li 2 O-Li 3 N, yang memfasilitasi difusi Li + yang cepat dan menekan dendrit. [ 19 ] 0,75 M LiDFOB sebagai co-salt untuk meningkatkan konduktivitas ionik melalui disosiasi pasangan ion yang lebih baik dan untuk menstabilkan katode melalui pembentukan CEI kaya LiF. [ 20 ]DME:VC (8:2 berdasarkan volume) sebagai sistem pelarut, dimana DME memastikan viskositas rendah untuk kinetika cepat, sementara VC berpolimerisasi untuk membentuk antarmuka hibrida organik-anorganik yang kuat di kedua elektroda. [ 11 ]
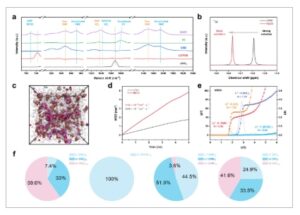
Spektroskopi Raman digunakan untuk menentukan struktur solvasi elektrolit NDDV ( Gambar 1a ; Gambar S1−S3 , Informasi Pendukung). Puncak pada 1068 cm −1 diamati untuk LiNO 3 padat , di mana
sebagian besar terkoordinasi dengan Li + . Pada elektrolit NDDV, puncak pada 1037 cm −1 sesuai dengan pasangan ion yang dipisahkan pelarut (SSIP)
, sedangkan puncak pada 1043 cm −1 disebabkan oleh pasangan ion kontak (CIP) dan agregat (AGG)
. [ 15 ] Untuk garam LiDFOB, keberadaan bentuk SSIP dari DFOB⁻ pada 709 cm −1 menunjukkan bahwa ia terdisosiasi dengan baik. Selain itu, masuknya DME ke dalam selubung solvasi pertama [ 21 ] dibuktikan dengan munculnya puncak baru pada 871 cm −1 dan puncak yang diintensifkan pada 1474 cm −1 . Demikian pula, pergeseran Raman yang lebih tinggi dari VC dalam elektrolit NDDV menunjukkan bahwa molekul VC dikoordinasikan dengan ion Li⁺ dan dimasukkan ke dalam selubung solvasi. Spektroskopi resonansi magnetik nuklir (NMR) kemudian digunakan untuk menyelidiki lingkungan kimia Li + dalam elektrolit yang berbeda (Gambar 1b ; Gambar S4 dan S5 , Informasi Pendukung). Pergeseran kimia 7 Li dalam elektrolit NDDV kurang negatif (−0,63 ppm) dibandingkan dengan yang ada dalam elektrolit LP40 komersial (−0,81 ppm; 1 M LiPF 6 dalam EC−DEC (1:1, berdasarkan volume)), menunjukkan interaksi yang lebih lemah antara Li + dan spesies lain dalam elektrolit NDDV dibandingkan dalam elektrolit LP40. [ 22 ] Solvasi lemah ini berasal dari keadaan CIP/AGG dominan dari Li + (Gambar 1f ), di mana Li⁺ mengikat langsung ke
daripada pelarut, mengurangi energi desolvasi.
Gambar 1
Buka di penampil gambar
Presentasi PowerPoint
Studi eksperimental dan teoritis tentang struktur solvasi Li + . a) Spektrum Raman dari LiNO3 , LiDFOB, pelarut DME, pelarut VC, dan elektrolit NDDV. b) 7 hasil perbandingan Li-NMR dari elektrolit LP40 dan NDDV. c) Gambaran simulasi dinamika molekular untuk elektrolit NDDV. d) Perpindahan kuadrat rata-rata (MSD) dan koefisien difusi Li + dalam elektrolit LP40 dan NDDV. e Fungsi distribusi radial terhitung (g(r), garis putus-putus) dan bilangan kumulatif (N(r), simbol garis +) untuk Li + dalam elektrolit NDDV. f) Distribusi bilangan koordinasi dari berbagai anion atau pelarut dalam elektrolit NDDV.
Simulasi dinamika molekul (MD) merupakan alat yang ampuh untuk menyelidiki struktur atom mikroskopis dan sifat-sifat makroskopis. [ 23 ] Konfigurasi atom MD (Gambar 1c ) menunjukkan bahwa sebagian besar
ion ada sebagai pasangan ion kontak (CIP) dan agregat (AGG), konsisten dengan hasil Raman (tidak ada label dan sulit dibaca dari snapshot). Kemudian, perpindahan kuadrat rata-rata (MSD) Li + dihitung dari lintasan setelah sistem mencapai kesetimbangan (Gambar 1d ). Koefisien difusi Li + dalam elektrolit NDDV (1,54 × 10 −6 cm 2 s −1 ) secara signifikan lebih tinggi daripada yang ada dalam elektrolit LP40 komersial (5,65 × 10 −7 cm 2 s −1 ), mungkin karena solvasi yang lebih lemah dalam elektrolit NDDV. Konduktivitas ionik elektrolit NDDV lebih tinggi daripada elektrolit LP40 komersial (Gambar S6 dan S7 , Informasi Pendukung). Struktur solvasi Li + dalam elektrolit yang berbeda dianalisis lebih lanjut (Gambar 1e–f ; Gambar S8 dan S9 , Informasi Pendukung). Dalam elektrolit NDDV, nomor koordinasi untuk
, DME dan VC masing-masing adalah 1,70, 0,56, dan 1,30, dengan DFOB⁻ tidak memasuki selubung solvasi. Analisis statistik solvat Li + menunjukkan bahwa 7,4% ion Li + ada sebagai pasangan ion yang dipisahkan pelarut (SSIP), sementara 33% dan 59,6% membentuk CIP dan AGG. Anion terkoordinasi secara eksklusif
, dengan DFOB⁻ absen dari selubung solvasi. Mengenai bilangan koordinasi DME, proporsi Li + (DME) 0 , Li + (DME) 1 , dan Li + (DME) ≥2 masing-masing adalah 44,5%, 51,9%, dan 3,6%. Selain itu, proporsi molekul VC yang lebih tinggi memasuki selubung solvasi Li⁺, dengan 33,5% Li + (VC) 1 dan 41,6% Li + (VC) 2 atau lebih. Spesies yang memasuki selubung solvasi Li⁺ lebih rentan terhadap reduksi, yang selanjutnya dapat mengarah pada pembentukan antarmuka elektrolit padat. [ 24 ]
3 Kinerja Elektrokimia Baterai Logam Litium
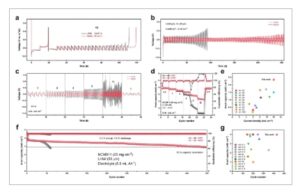
Untuk mengembangkan elektrolit baru untuk LMB, elektrolit harus kompatibel dengan anoda dan katoda logam litium. Pertama, efisiensi coulombik (CE) dari setengah-sel Li || Cu digunakan untuk mengevaluasi reversibilitas anoda logam litium. Seperti yang ditunjukkan pada Gambar 2a , CE Aurbach dari sel Li || Cu dengan elektrolit NDDV adalah 99,38%, secara signifikan lebih tinggi daripada 84,67% CE yang diamati dengan elektrolit LP40 komersial. Selain itu, sel Li || Cu menunjukkan kelebihan potensial nukleasi yang rendah dan kelebihan potensial deposisi litium yang stabil selama proses siklus (Gambar S10 , Informasi Pendukung). Berikutnya, sel simetris Li (50 µm) || Li (50 µm) digunakan untuk menilai kinerja siklus, dengan kapasitas 2 mAh cm −2 di bawah kerapatan arus 2 mA cm −2 (Gambar 2b ). Siklus hidup Li || Sel simetris Li dengan elektrolit NDDV (250 jam) secara signifikan lebih lama daripada dengan elektrolit LP40 (<100 jam). Kinerja laju sel simetris Li || Li juga dievaluasi (Gambar 2c ). Rata-rata kelebihan potensial pengendapan litium untuk elektrolit LP40 pada kerapatan arus 1, 2, 3, dan 5 mA cm −2 masing-masing adalah 90, 132, 168, dan 315 mV. Sebaliknya, elektrolit NDDV menunjukkan kelebihan potensial pengendapan litium yang jauh lebih rendah, yaitu 32, 45, 60, dan 85 mV pada kondisi yang sama. Secara signifikan, sel simetris Li || Li dapat beroperasi pada kerapatan arus 8 mA cm −2 , dengan kelebihan potensial pengendapan 133 mV, sedangkan elektrolit LP40 gagal mendukung sel Li || Li pada kerapatan arus yang tinggi tersebut. Kepadatan arus tukar (ECD) merupakan parameter penting untuk mengevaluasi kinetika reaksi. [ 25 ] ECD dari elektrolit LP40 dan NDDV diuji menggunakan konfigurasi sel simetris Li || Li pada kepadatan arus rendah dan overpotensial tinggi (Gambar S11 dan S12 , Informasi Pendukung). Dalam kedua skenario, elektrolit NDDV menunjukkan ECD yang jauh lebih tinggi daripada elektrolit LP40.
Gambar 2
Buka di penampil gambar
Presentasi PowerPoint
Kinerja elektrokimia elektrolit berbasis LiNO3 dalam berbagai konfigurasi sel logam Li. a) CE pelapisan/pelepasan Li dievaluasi melalui pengukuran Aurbach menggunakan sel koin Li || Cu. b) Kinerja siklus sel simetris foil Li (50 µm) || foil Li (50 µm) dengan elektrolit LP40 dan NDDV. c) Kinerja laju sel simetris foil Li (50 µm) || foil Li (50 µm) dengan elektrolit LP40 dan NDDV. d) Kinerja laju sel penuh NCM811 (20 mg cm −2 ) || foil Li (50 µm) dengan elektrolit LP40 dan NDDV. e) Perbandingan kapasitas areal sel koin logam litium di bawah rapat arus tinggi terhadap kondisi praktis melalui modifikasi elektrolit. Elektrolit yang diberi label dalam gambar ini dilaporkan dalam literatur. f) Kinerja siklus sel penuh NCM811 (20 mg cm −2 ) || Li foil (50 µm) (rasio elektrolit/katode: 5,6 mL Ah −1 ) dengan elektrolit LP40 dan NDDV. g) Perbandingan siklus hidup sel koin logam litium terhadap kondisi praktis melalui modifikasi elektrolit. (Anoda litium tidak lebih tebal dari 60 µm). Elektrolit yang diberi label dalam gambar ini dilaporkan dalam literatur.
LiNi 0,8 Co 0,1 Mn 0,1 O 2 (NCM811, 20 mg cm −2 ) Sel || Li (50 µm) dirakit untuk mengevaluasi kinerja elektrokimia dalam kondisi praktis. Mengingat elektrolit NDDV menunjukkan kinetika cepat pada anoda logam litium, pertama-tama kami menguji kinerja laju sel NCM811 || Li. Seperti yang ditunjukkan pada Gambar 2d , kapasitas pelepasan sel NCM811 || Li dengan elektrolit LP40 pada rapat arus 0,5, 1, 2, 4, 8, dan 12 mA cm −2 masing-masing adalah 3,88, 3,74, 3,45, 2,93, 1,14, dan 0,3 mAh cm −2 . Sebaliknya, elektrolit NDDV mencapai kapasitas pelepasan sebesar 3,86, 3,74, 3,54, 3,31, 2,82, dan 2,35 mAh cm −2 pada kerapatan arus yang sama (Gambar S13 , Informasi Pendukung). Kapasitas pelepasan areal sebesar 2,35 mAh cm −2 pada 12 mA cm −2 termasuk di antara kinerja laju terbaik untuk sel penuh NCM || Li pada kondisi praktis (Gambar 2e ; Tabel S2 , Informasi Pendukung). Berikutnya, kami menguji kinerja siklus jangka panjang dari sel NCM811 || Li (Gambar 2f ). Pada kondisi beban massa katode tinggi (20 mg cm −2 ), rasio negatif/positif rendah (rasio N/P), dan elektrolit ramping (5,6 mL Ah −1 ), NCM811 || Sel Li dengan elektrolit LP40 hanya mampu mempertahankan 54 siklus (pengisian 0,2 C, pengosongan 0,5 C, 1 C = 200 mA g −1 ) sebelum mencapai retensi kapasitas 80%. Sebaliknya, elektrolit NDDV memungkinkan sel NCM811 || Li beroperasi selama 430 siklus dengan retensi kapasitas 80% dalam kondisi praktis (Gambar S14 , Informasi Pendukung), yang mewakili salah satu kinerja siklus terbaik yang dilaporkan untuk sel NCM811 || Li dalam kondisi yang sama (Gambar 2g , Tabel S3 , Informasi Pendukung). Khususnya, secara bersamaan mencapai kemampuan pengisian cepat dan stabilitas tegangan tinggi melalui rekayasa elektrolit tetap menjadi tantangan. Dalam kasus ini, elektrolit NDDV menunjukkan ketidakstabilan saat diisi ke tegangan tinggi (≈4,8 V) (Gambar S15 , Informasi Pendukung). Akhirnya, kami merakit NCM811 (25 mg cm −2 ) || Sel bebas anoda Cu untuk menilai kinerja siklus (Gambar S16 dan S17, Informasi Pendukung). Untuk elektrolit LP40, kapasitasnya hampir turun ke nol setelah 50 siklus (pengisian 0,1 C, pengosongan 0,3 C). Namun, elektrolit NDDV menunjukkan siklus hidup yang jauh lebih baik, dengan retensi kapasitas 82,2% setelah 60 siklus. Kinerja elektrokimia yang unggul dari sel NCM811 (20 mg cm −2 ) || Li (50 µm) dengan elektrolit NDDV menunjukkan bahwa elektrolit berbasis LiNO 3 kami dapat mengungguli elektrolit berbasis LiFSI canggih untuk LMB. Di luar kinerja, sistem LiNO 3 -LiDFOB menawarkan manfaat ekonomi melalui bahan yang lebih murah dan kimia yang lebih sederhana. Skala industri dapat lebih mengurangi biaya, karena rantai pasokan LiNO 3 yang mapan kontras dengan garam khusus seperti LiFSI (Tabel S4 , Informasi Pendukung).
4 Morfologi Deposisi Litium dan Analisis SEI
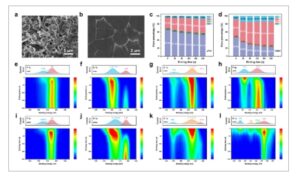
Mikroskop elektron pemindaian (SEM) digunakan untuk mengamati morfologi pengendapan litium. Dalam elektrolit NDDV, endapan litium tampak besar, padat, dan tebal ( Gambar 3b ), berbeda dengan struktur dendritik yang diamati dalam elektrolit LP40 (Gambar 3a ; Gambar S18 , Informasi Pendukung). Analisis lebih lanjut menggunakan spektroskopi fotoelektron sinar-X (XPS) mendalam dilakukan untuk mengidentifikasi komponen SEI luar dan dalam. Rasio atom berbagai elemen dalam SEI yang terbentuk dalam berbagai elektrolit (Gambar 3c , d ) mengungkapkan bahwa spesies yang mengandung karbon dalam SEI yang terbentuk dalam elektrolit NDDV (24,3% setelah 240 detik) secara signifikan lebih rendah daripada yang ada dalam SEI yang terbentuk dalam elektrolit LP40 (53,4% setelah 240 detik). Selain itu, SEI yang terbentuk dalam elektrolit NDDV mengandung jumlah oksigen dan fluor yang lebih tinggi, bersama dengan kadar nitrogen yang dapat dideteksi. Spektrum F 1s XPS mengindikasikan bahwa fluorin dalam SEI bagian dalam terutama ada dalam bentuk LiF (Gambar 3e,i ; Gambar S19 , Informasi Pendukung), suatu senyawa yang diketahui meningkatkan stabilitas SEI untuk anoda logam litium. [ 26 ] Spektrum O 1s mengindikasikan bahwa SEI bagian luar sebagian besar tersusun atas komponen-komponen kaya organik (C−O, P−O, B−O), sementara SEI bagian dalam mengandung Li 2 O untuk kedua elektrolit (Gambar 3f,g ; Gambar S20 , Informasi Pendukung). Khususnya, kandungan Li 2 O jauh lebih tinggi dalam SEI yang terbentuk dalam elektrolit NDDV dibandingkan dengan elektrolit LP40. Studi terkini telah menunjukkan bahwa Li 2 O merupakan komponen kritis untuk meningkatkan reversibilitas anoda logam litium, dengan kandungannya yang lebih berkorelasi kuat dengan CE dari setengah-sel Li || Cu dibandingkan komponen SEI lainnya. [ 27 ] Spektrum C 1s XPS mengungkapkan bahwa seiring dengan peningkatan kedalaman etsa, lebih sedikit spesies organik mengandung karbon yang terdeteksi dalam SEI yang terbentuk dalam elektrolit NDDV dibandingkan dengan elektrolit LP40 (Gambar 3g,k ; Gambar S21 , Informasi Pendukung). Spektrum P 2p XPS menunjukkan keberadaan ikatan P−O dalam SEI yang terbentuk dalam elektrolit LP40 (Gambar 3h ), sedangkan spektrum N 1s XPS mendeteksi Li 3 N dari SEI luar ke dalam SEI dalam elektrolit NDDV (Gambar 3l ; Gambar S22 , Informasi Pendukung). Li 3 N, yang dikenal karena konduktivitas ionik Li + yang sangat tinggi , memfasilitasi transportasi Li + dalam SEI anoda logam litium.19 ]Singkatnya, SEI yang terbentuk dalam elektrolit NDDV terdiri dari dua lapisan berbeda: SEI organik kaya karbon di bagian luar dan SEI anorganik kaya Li2O di bagian dalam. Struktur dwilapis ini memastikan reversibilitas anoda logam litium, dengan LiF dan Li3N berkontribusi pada kekuatan mekanis SEI dan difusi Li+.
Gambar 3
Buka di penampil gambar
Presentasi PowerPoint
Karakterisasi antarmuka anoda-elektrolit. a, b) SEM morfologi pengendapan logam Li (0,5 mA cm −2 , 5 mAh cm −2 ) dalam elektrolit LP40 (a) dan elektrolit NDDV (b). c, d) Rasio atomik unsur yang terdeteksi pada permukaan logam Li yang didaur ulang dalam elektrolit LP40 (c) dan elektrolit NDDV (d). e–h) Pengukuran XPS profil kedalaman F1s (e), O1s (f), C1s (g), dan N1s (h) untuk permukaan logam Li dalam elektrolit LP40. i–l) Pengukuran XPS profil kedalaman F1s (i), O1s (j), C1s (k), dan P 2p (l) untuk permukaan logam Li dalam elektrolit NDDV. Setiap plot terdiri dari dua gambar individual, yaitu komponen yang sesuai (atas) dan spektrum profil kedalaman (bawah). Batang warna menunjukkan intensitas dari lemah ke kuat dari bawah ke atas.
5 Mekanisme Reaksi Interfase Anoda-Elektrolit
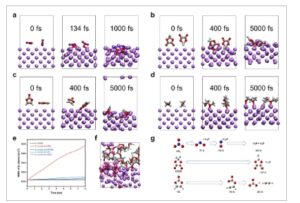
Simulasi dinamika molekul ab initio (AIMD) digunakan untuk menyelidiki reaksi antara logam litium dan berbagai spesies elektrolit. Seperti yang ditunjukkan pada Gambar 4a , dalam waktu hanya 134 fs, atom oksigen dari anion nitrat mulai teradsorpsi ke atom litium permukaan. Pada 1000 fs, anion nitrat telah bereaksi sepenuhnya, membentuk Li 3 N dan Li 2 O (Gambar S23 , Informasi Pendukung), dengan atom nitrogen dan oksigen berdifusi dalam ke logam litium (Film S1 , Informasi Tambahan). Fungsi distribusi radial (RDF) antara Li dan N, O mengungkapkan puncak pertama pada ≈2 Å, yang sesuai dengan jarak atom dalam kristal Li 3 N dan Li 2 O (Gambar S24 , Informasi Pendukung). Untuk reaksi antara anion BFOB⁻ dan logam litium, adsorpsi pada permukaan logam litium dimulai setelah 400 fs, dengan satu atom fluor mudah terdisosiasi membentuk LiF, sementara struktur yang tersisa tetap ada sebagai komponen organik tunggal dalam SEI (Gambar 4b ; Gambar S25 dan S26 (Informasi Pendukung) dan Film S2 , Informasi Tambahan). Dalam reaksi antara VC dan logam litium, ikatan C−O putus, menyebabkan terbentuknya spesies organik yang mengandung karbon pada permukaan logam litium (Gambar 4c ; Gambar S27 dan S28 (Informasi Pendukung) dan Film S3 , Informasi Tambahan). Sebaliknya, molekul DME tetap relatif stabil dengan logam litium, dengan hanya atom oksigen yang teradsorpsi pada permukaan logam litium selama keseluruhan simulasi (Gambar 4d ; Gambar S29 (Informasi Pendukung) dan Film S4 , Informasi Tambahan).
Gambar 4
Buka di penampil gambar
Presentasi PowerPoint
Reaksi antarmuka proses pembentukan SEI pada permukaan anoda logam Li dari simulasi AIMD. a) Gambaran tampilan samping simulasi AIMD 0, 134, dan 1000 fs untuk reaksi antara SEI dan SEI.
dan lempengan logam litium. b) Gambaran samping simulasi AIMD 0, 400, dan 5000 fs untuk reaksi antara DFOB − dan lempengan logam litium. c) Gambaran samping simulasi AIMD 0, 400, dan 5000 fs untuk reaksi antara VC dan lempengan logam litium. d) Gambaran samping simulasi AIMD 0, 400, dan 5000 fs untuk reaksi antara DME dan lempengan logam litium. e) Perpindahan kuadrat rata-rata (MSD) atom litium dalam sistem yang berbeda. f) Gambaran samping simulasi AIMD 10 ps untuk reaksi antara elektrolit NDDV dan lempengan logam litium. g) Mekanisme reaksi dekomposisi yang diusulkan berdasarkan simulasi AIMD elektrolit NDDV.
Untuk menjelaskan asal-usul kinetika cepat, MSD atom litium dihitung untuk setiap simulasi yang melibatkan logam litium dan berbagai spesies elektrolit, termasuk logam litium murni itu sendiri (Gambar 4e ; Film S5 , Informasi Tambahan). Hasilnya menunjukkan bahwa reaksi antara logam litium dan anion nitrat menunjukkan kemiringan paling curam, yang sesuai dengan koefisien difusi litium sebesar 1,49 × 10⁻ 5 cm 2 s⁻ 1 . Simulasi selanjutnya dengan elektrolit NDDV mengungkapkan pembentukan SEI bagian dalam yang didominasi Li 2 O dan SEI bagian luar yang kaya organik (Gambar 4f ). Kehadiran LiF dan Li 3 N juga diamati, sesuai dengan hasil XPS yang mendalam. Transportasi Li + yang cepat dalam SEI yang didominasi Li 2 O – Li 3 N, dikombinasikan dengan difusi cepat Li + dalam elektrolit NDDV massal, menjelaskan kinetika yang dipercepat yang diamati dalam baterai yang menggunakan elektrolit NDDV. Akhirnya, mekanisme dekomposisi untuk spesies yang berbeda dalam elektrolit NDDV diklarifikasi: anion nitrat cepat terurai menjadi Li 3 N dan Li 2 O, LiF terbentuk melalui defluorinasi anion DFOB⁻, dan VC terutama berkontribusi pada pembentukan komponen organik (Film S6 , Informasi Tambahan). SEI anorganik yang didominasi Li 2 O bagian dalam dan SEI kaya organik bagian luar memastikan pelapisan dan pelepasan logam litium yang reversibel, dengan Li 3 N dalam SEI memfasilitasi transportasi Li + yang cepat.
6 Simulasi dan Karakterisasi Antarmuka Katoda-Elektrolit
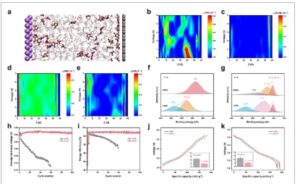
Simulasi MD dilakukan untuk menyelidiki distribusi berbagai spesies elektrolit pada berbagai potensial di permukaan katode ( Gambar 5a ). Hasilnya menunjukkan bahwa.
dan ion Li + tidak menunjukkan distribusi terkonsentrasi di berbagai potensi, mungkin karena pembentukan CIP dan AGG yang melibatkan
(Gambar 5b ; Gambar S30 dan S31 , Informasi Pendukung). Sebaliknya, hampir semua anion DFOB⁻ ditemukan pada permukaan katode, khususnya pada potensial tinggi (Gambar 5c ; Gambar S29 , Informasi Pendukung). Adsorpsi istimewa anion DFOB⁻ ini pada potensial tinggi menunjukkan kecenderungan anion ini untuk terurai secara istimewa. Khususnya, anion DFOB⁻ dikenal sebagai aditif efektif untuk katode tegangan tinggi, menstabilkan antarmuka katode/elektrolit (CEI). [ 28 ] Mengenai distribusi molekul DME, mayoritas diadsorpsi ke permukaan logam litium pada semua potensial. Namun, pada potensial tinggi, terdapat penipisan molekul DME yang nyata pada ≈54,5 Å (Gambar 5d ; Gambar S32 , Informasi Pendukung). Selain itu, distribusi molekul VC secara konsisten menunjukkan preferensi untuk adsorpsi di dekat permukaan katode (Gambar S32 , Informasi Pendukung). Adsorpsi preferensial anion DFOB⁻ dan molekul VC, daripada molekul DME, sangat penting untuk stabilitas luar biasa elektrolit NDDV berbasis eter di bawah tegangan tinggi. Selanjutnya, analisis XPS digunakan untuk menentukan komponen CEI. Spektrum F 1s mengungkapkan keberadaan LiF anorganik dalam CEI yang terbentuk dalam elektrolit NDDV, yang kontras dengan spesies yang mengandung fluor organik yang diamati dalam CEI yang terbentuk dengan elektrolit LP40 (Gambar 5f ). Lebih jauh, spektrum C 1s menunjukkan kandungan spesies yang mengandung karbon yang lebih rendah dalam CEI yang terbentuk dengan elektrolit NDDV (Gambar 5g ). CEI yang kaya LiF berkontribusi pada stabilisasi katode NCM811 dalam kondisi tegangan tinggi.
Gambar 5
Buka di penampil gambar
Presentasi PowerPoint
Karakterisasi dan hasil simulasi komputasional dari antarmuka katode-elektrolit. a) Gambaran skema (tampilan samping) struktur antarmuka dalam elektrolit NDDV dengan potensi keseluruhan yang diterapkan (U = 4 V). b–e) Kepadatan jumlah
(b), DFOB − (c), DME (d), dan VC (e) dalam elektrolit NDDV sebagai fungsi jarak dari elektroda logam litium (Z = 0 Å) pada berbagai potensial. f–g) Spektrum F 1s (j), dan C 1s (k) dari katode NCM811 yang didaur ulang menggunakan elektrolit yang berbeda. h–i) Tegangan pelepasan rata-rata (h) dan efisiensi energi (i) dari sel penuh NCM811 (20 mg cm −2 ) || Foil Li (50 µm) dengan elektrolit LP40 dan NDDV. j–k) Profil tegangan pengisian (j) dan pelepasan (k) dari pengukuran teknik titrasi intermiten galvanostatik dari sel penuh NCM811 (20 mg cm −2 ) || Foil Li (50 µm) dengan elektrolit LP40 dan NDDV setelah 50 siklus.
Untuk menilai stabilitas katode NCM811 dan CEI, potensi pelepasan rata-rata dan efisiensi energi dievaluasi selama siklus untuk elektrolit yang berbeda. Potensi pelepasan rata-rata sel NCM811 || Li tetap stabil pada 3,84 V selama proses siklus saat menggunakan elektrolit NDDV (Gambar 5h ). Sebaliknya, potensi pelepasan rata-rata untuk sel dengan elektrolit LP40 menunjukkan penurunan terus-menerus selama siklus. Selain itu, efisiensi energi sel NCM811 || Li dengan elektrolit NDDV secara konsisten tinggi dan stabil pada 98%, sedangkan efisiensi energi dengan elektrolit LP40 memburuk dengan cepat. Untuk lebih membandingkan resistansi yang terkait dengan transpor Li + melalui CEI, teknik titrasi intermiten galvanostatik (GITT) digunakan. Overpotensial selama proses pengisian dan pengosongan secara signifikan lebih rendah untuk elektrolit NDDV (≈5 mV) dibandingkan dengan elektrolit LP40 (≈12 mV). Hasil serupa diperoleh melalui spektroskopi impedansi elektrokimia (EIS) (Gambar S33 , Informasi Pendukung). Hasil ini menunjukkan bahwa struktur katode NCM811 tetap stabil, dan resistansi CEI relatif rendah saat elektrolit NDDV digunakan.
Singkatnya, kami mengembangkan elektrolit berbasis LiNO3 untuk baterai logam litium yang menunjukkan kompatibilitas yang sangat baik dengan anoda logam litium dan kinetika yang cepat. Sel Li||Cu mencapai CE yang tinggi sebesar 99,38%, sementara sel Li||Li menunjukkan kelebihan potensial pengendapan litium yang rendah sebesar 133 mV pada 8 mA cm⁻2 . Pada sel penuh, NCM811 (20 mg cm⁻2 ) ||Li (50 µm) menunjukkan siklus hidup 430 siklus dengan retensi kapasitas 80%. Selain itu, kinerja laju yang luar biasa sebesar 2,35 mAh cm⁻2 pada 12 mA cm⁻2 tercapai . Untuk pertama kalinya, siklus hidup yang panjang dan kinerja laju yang sangat baik dalam kondisi praktis telah ditunjukkan untuk sel NCM811||Li menggunakan elektrolit berbasis LiNO3 . Kinerja yang luar biasa muncul dari peran pelengkap LiNO3 dan LiDFOB. LiNO3 membentuk SEI Li2O-Li3N konduktif di anoda , sementara LiDFOB meningkatkan transportasi ion massal dan menciptakan CEI kaya LiF yang protektif di katoda. Pembagian kerja yang strategis ini memungkinkan peningkatan simultan dalam stabilitas siklus, kemampuan laju, dan kompatibilitas antarmuka – mengatasi tantangan utama dalam baterai logam litium. Pekerjaan kami menunjukkan bahwa elektrolit berbasis LiNO3 berbiaya rendah ini dapat mengungguli elektrolit berbasis LiFSI canggih untuk baterai logam litium.
7 Bagian Eksperimen
Bahan
Litium nitrat anhidrat (LiNO 3 ) (99%), dan polivinilidena fluorida (PVDF) diperoleh dari Alfa Asear. Dimetoksietana (DME) (99,5%), N-Metil-2-pirolidon (NMP), dan larutan litium heksafluorofosfat (1,0 m LiPF 6 dalam EC/DEC = 50/50 (v/v), mutu baterai) diperoleh dari Sigma-Aldrich. Lembaran Li (400 µm) dan foil (50 µm) dibeli dari China Energy Lithium Co., Ltd. Litium difluoro(oksalat)borat (LiDFOB), vinilen karbonat (VC), litium nikel kobalt mangan oksida (LiNi 0,8 Co 0,1 Mn 0,1 O 2 , NCM811), dan Super P dibeli dari Guangdong Canrd New Energy Technology Co., Ltd. dan digunakan sebagaimana diterima. Elektroda katode disiapkan dengan mencampur NCM811, super P, dan pengikat PVDF dengan rasio massa 90: 5: 5 dalam NMP dan melapisi bubur tersebut pada aluminium foil, diikuti dengan pemotongan menjadi cakram dengan diameter 12 mm dan pengeringan semalam pada suhu 80 °C dalam oven vakum. Pembebanan massa untuk bahan aktif adalah ≈20 atau 25 mg cm −2 .
Persiapan Elektrolit
Untuk elektrolit NDDV (1 M LiNO3 + 0,75 M LiDFOB dalam DME-VC (8: 2, berdasarkan volume)), sejumlah LiNO3 dan LiDFOB yang sesuai ditambahkan ke dalam pelarut DME, dan larutan tersebut terus diaduk hingga semua garam larut. Setelah itu, sejumlah volume VC yang sesuai ditambahkan ke elektrolit di atas. Akhirnya, elektrolit akhir terus diaduk selama 48 jam sebelum digunakan.
Perhitungan Teoritis
Simulasi dinamika molekul dilakukan dengan menggunakan Large-scale Atomic/Molecular Massively Parallel Simulator (LAMMPS) [ 29 ] dan Optimized Potential for Liquid Simulations-all atom (OPLS-AA) force field. [ 30 ] Pertama adalah penentuan struktur solvasi. Untuk elektrolit LP40, 100 LiPF 6 , 750 EC, dan 405 molekul DEC ditambahkan ke kotak 60 × 60 × 60 Å 3. Untuk elektrolit NDDV, 100 LiNO 3 , 75 LiDFOB, 770 DME, dan 316 molekul VC ditambahkan ke kotak 60 × 60 × 60 Å 3. Parameter medan gaya EC, DEC, DME, dan VC diperoleh dari server web LigParGen [ 31 ] dan muatan RESP diadopsi oleh Multiwfn. [ 32 ] Parameter medan gaya Li + ,
Bahasa Indonesia:
, dan DFOB − diambil dari publikasi sebelumnya [ 33 ] dan skala muatan 0,8 diadopsi untuk meniru efek polarisasi dan transfer muatan. Sistem awalnya disiapkan dengan menggunakan perangkat lunak Packmol [ 34 ] dan Moltemplate [ 35 ] . Kondisi batas periodik (PBC) diterapkan di ketiga arah. Batas 12 Å digunakan untuk interaksi van der Waals dan interaksi partikel-partikel-jaring koreksi jarak jauh dari interaksi Coulomb.
Untuk struktur solvasi, minimisasi energi awal pada 0 K (toleransi energi dan gaya 10 −6 ) dilakukan untuk memperoleh struktur keadaan dasar. Kemudian simulasi dimulai dengan NVT 200 ps dari 0 hingga 298 K. Kemudian, sistem diseimbangkan pada 298 K dan 1 atm dalam ensembel NPT selama 10 ns. Akhirnya, proses produksi dilakukan dalam ensembel NPT selama 5 ns. Struktur solvasi diperoleh dan dianalisis selama proses produksi. Perangkat lunak VMD digunakan untuk memvisualisasikan snapshot dan menganalisis hasilnya. [ 36 ] Persentase struktur solvasi yang berbeda dan koefisien difusi dianalisis dengan skrip Python yang kami tulis. Langkah waktu 1 fs digunakan untuk semua simulasi.
Untuk simulasi lapisan ganda elektrokimia, model elektrolit NDDV mengandung 27 LiNO3 , 20 LiDFOB, 208 DME, dan 85 molekul VC. Satu lempengan graphene dan satu lempengan logam lithium dua lapis ditambahkan untuk mewakili elektroda positif dan negatif. Untuk mengurangi efek Coulomb antara lempengan cermin karena kondisi batas periodik, lapisan vakum setebal 6 nm diperluas ke arah sumbu z. Perbedaan potensial dikontrol oleh metode potensial konstan (CPM) menggunakan paket ELECTRODE [ 37 ] di LAMMPS. Minimalisasi energi awal pada 0 K (toleransi energi dan gaya 10−6 ) dilakukan untuk mendapatkan struktur keadaan dasar. Kemudian simulasi dimulai dengan NVT 200 ps dari 0 hingga 298 K. Kemudian, sistem diseimbangkan pada 298 K dalam ensembel NVT selama 3 ns. Akhirnya, proses produksi dilakukan dalam ensemble NVT selama 2 ns. Distribusi kepadatan diperoleh dan dianalisis selama proses produksi. Perangkat lunak VMD digunakan untuk memvisualisasikan snapshot dan menganalisis hasilnya. [ 36 ] Langkah waktu 1 fs digunakan untuk semua simulasi.
Simulasi dinamika molekul ab initio (AIMD) menggunakan pendekatan Born-Oppenheimer dilakukan untuk menyelidiki reaktivitas elektrolit dengan logam Li menggunakan paket CP2K/Quickstep. [ 38 ] DFT yang diimplementasikan dalam CP2K didasarkan pada skema gelombang bidang Gaussian hibrid. Orbital molekul elektron valensi diekspansi menjadi set basis DZVP-MOLOPT-PBE-Goedecker-Teter-Hutter (GTH), sedangkan interaksi dengan inti dijelaskan melalui pseudopotensial GTH-PBE. Energi batas ditetapkan pada 400 Ry. Kriteria konvergensi energi elektronik 1 × 10 −4 eV dan langkah waktu 1 fs digunakan untuk simulasi dinamika molekul ab initio. Untuk reaksi antara logam litium dan spesies elektrolit individu yang berbeda, struktur pelat anoda logam Li dibuat menggunakan lima lapisan logam Li yang memperlihatkan faset energi permukaan terendah (100). Lapisan vakum 15 Å ditambahkan di atas permukaan logam Li pada arah z, menyediakan ruang tempat elektrolit berada. Untuk reaksi antara logam litium dan elektrolit NDDV, ketebalan lapisan vakum adalah 9 Å. Jumlah spesies yang berbeda dihitung berdasarkan kepadatan sebenarnya. Geometri awal elektrolit dibuat dengan Packmol. [ 34 ] Simulasi AIMD kemudian dilakukan pada suhu 298 K menggunakan termostat CSVR. Simulasi dinamis selama 10 ps dilakukan untuk menganalisis perilaku reaksi. Perangkat lunak VMD digunakan untuk memvisualisasikan snapshot dan film. Koefisien difusi dianalisis dengan skrip Python yang ditulis oleh kami.
Karakterisasi Material
7 spektrum Li-NMR direkam pada spektrometer dua saluran Agilent/Varian Inova 400 MHz pada suhu ruangan. Mikroskop Raman Renishaw InVIa dengan laser 532 nm digunakan untuk pengukuran Raman. Pengamatan morfologi anoda logam Li dilakukan pada mikroskop elektron pemindaian emisi medan (FESEM, Zeiss EVO M10). Untuk pengukuran XPS dan XPS mendalam, setiap foil Cu yang diendapkan dengan Li (setelah sepuluh siklus sel Li || Cu) atau katode NMC811 (setelah 50 siklus sel NMC811 || Li) dicuci dengan DME untuk menghilangkan elektrolit yang tersisa. Kemudian sampel dipindahkan dan disegel ke dalam bejana transfer di kotak sarung tangan berisi argon. Profil XPS dikumpulkan dengan XPS Versa Probe III (PHI 5000) dan nilai energi pengikatan semua data dirujuk ke puncak C 1s (284,6 eV). Konduktivitas ionik elektrolit diukur melalui pengukur konduktivitas FiveGo F3 (Mettler Toledo) pada suhu 25 °C.
Pengukuran Fisika dan Elektrokimia
Separator polipropilena (PP) Celgard 2500 dengan diameter 16 mm digunakan dalam penelitian ini. Konduktivitas separator setelah direndam dalam elektrolit dihitung dengan persamaan berikut:
, di mana σ s melambangkan konduktivitas pemisah basah, d , dan A berhubungan dengan ketebalan dan luas kontak pemisah, dan R s adalah impedansi sel simetris baja tahan karat (SS) | pemisah basah | SS, yang dapat diperoleh dari perpotongan plot Nyquist dan sumbu x.
Semua komponen baterai yang digunakan dalam pekerjaan ini tersedia secara komersial dan semua uji elektrokimia dilakukan dalam konfigurasi sel koin tipe 2032 pada instrumen Newware. Semua sel koin dibuat dalam glovebox berisi argon. Dan setiap sel disuntikkan ke dalam elektrolit 60 atau 30 µL. Dalam sel Li || Cu, lembaran Li dengan ketebalan 400 µm diaplikasikan sebagai elektroda referensi dan lawan, sedangkan foil Cu digunakan sebagai elektroda kerja. Untuk sel penuh dan sel Li tipis || Li tipis, foil Li dengan ketebalan 50 µm digunakan. EIS dilakukan pada sistem Biologic VMP3. Pengukuran EIS dilakukan pada rentang frekuensi 10 5 hingga 10 −2 Hz dan amplitudo tegangan 10 mV. Pengisian/pengosongan galvanostatik pada berbagai arus dari 20 hingga 120 µA dilakukan untuk mengekstraksi kelebihan potensial dan menghitung kerapatan arus pertukaran menggunakan persamaan:
, di mana η adalah total overpotensial. Pengujian LSV dilakukan pada rentang tegangan −0,21 hingga 0,21 V dalam sel Li || Li dengan laju pemindaian 1 mV s −1 setelah 10 siklus (1 mAh cm −2 , 1 mA cm −2 ). Untuk pengujian CE setengah sel Li || Cu, sepuluh prasiklus antara 0 dan 1 V diinisialisasi untuk membersihkan permukaan elektroda Cu, dan kemudian siklus dilakukan dengan mendepositkan 1 mAh cm −2 Li ke elektroda Cu diikuti dengan pengupasan hingga 1 V. CE dihitung dengan membagi total kapasitas pengupasan dengan total kapasitas deposisi setelah siklus pembentukan. Untuk uji Aurbach CE, [ 39 ] protokol standar diikuti: 1) melakukan satu siklus pembentukan awal dengan pengendapan Li sebesar 5 mAh cm −2 pada Cu di bawah kepadatan arus 0,5 mA cm −2 dan pelepasan ke 0,5 V; 2) mendepositkan 5 mAh cm −2 Li pada Cu di bawah 0,5 mA cm −2 sebagai reservoir Li; 3) berulang kali melepas/mendepositkan Li sebesar 0,5 mAh cm −2 di bawah 0,5 mA cm −2 selama 20 siklus; 4) melepas semua Li ke 0,5 V. Sel-sel Li NMC811 || didaur ulang dengan metode berikut: setelah dua siklus aktivasi pertama pada pengisian/pengosongan 0,1 C, sel-sel didaur ulang pada pengisian 0,2 C dan pengosongan 0,5 C (1 C = 200 mA g −1 ). Sel Cu didaur ulang dengan metode berikut: setelah dua siklus aktivasi pertama pada pengisian/pengosongan 0,1 C, sel didaur ulang pada pengisian 0,1 C dan pengosongan 0,3 C. Sel koin berbasis NMC811 didaur ulang antara 3,0 dan 4,3 V. Kinerja laju baterai penuh dievaluasi dengan rentang pengisian/pengosongan yang berubah dari 0,5 hingga 12 mA cm −1 dalam elektrolit yang berbeda dalam 3,0–4,3 V (vs. Li + /Li).

