
Abstrak
Silikon dianggap sebagai bahan anoda aktif yang menarik untuk baterai lithium-ion karena kapasitas teoritis dan kelimpahannya yang tinggi. Namun, penerapan anoda silikon terhalang oleh perubahan volume yang besar selama siklus pengisian-pengosongan dan konduktivitas yang rendah. Di sini, desain struktural difokuskan dan metode yang dapat diskalakan dikembangkan untuk memproduksi elektroda Si berpori dengan karakteristik elektrokimia dan sifat siklus yang sangat baik. Bubuk Al 72,5 Si 25 Ti 2,5 dengan struktur pemadatan halus diproduksi menggunakan metode atomisasi gas, dan partikel Ti(Al,Si) 2 @Si berpori dengan kerangka silikon yang seragam disintesis dengan melarutkan Al dalam prekursor bubuk yang diatomisasi menggunakan asam klorida. Partikel Ti(Al,Si) 2 @Si berpori menunjukkan distribusi ukuran pori 50–200 nm dan menunjukkan karakteristik laju yang sangat baik dengan kapasitas 1683 mAh g −1 setelah 100 siklus, efisiensi Coulombik >97%, dan stabilitas tinggi. Partikel-partikel tersebut mempertahankan kapasitas pelepasan muatan pada kapasitas pengisian konstan sebesar 1000 mAh g −1 pada suhu 0,2 C hingga 1000 siklus tanpa degradasi. Pori-pori tersebut menimbulkan efek penyangga yang menekan ekspansi volume selama penyisipan litium sementara fase silisida Ti(Al,Si) 2 meningkatkan konduktivitas listrik, sehingga meningkatkan laju dan kinerja siklus.
1 Pendahuluan
Meningkatnya permintaan baterai lithium-ion (LIB) dengan cepat, khususnya pada produk konsumen, seperti kendaraan listrik, telah menyebabkan kebutuhan untuk meningkatkan kepadatan energi dan kepadatan volumetriknya. [ 1 – 3 ] Sebagian besar LIB yang tersedia secara komersial menggunakan material berbasis grafit sebagai anoda karena kelebihannya, seperti biaya rendah, efisiensi pengisian-pengosongan yang tinggi, dan karakteristik siklus yang panjang. Namun, kapasitas gravimetriknya yang rendah (≈372 mAh g −1 ) telah mendorong penelitian ke dalam material elektroda alternatif dengan kapasitas yang lebih tinggi pada tegangan rendah. Silikon (Si) adalah material aktif yang menjanjikan karena kapasitas teoritisnya yang tinggi (≈3579 mAh g −1 dalam kasus Li 15 Si 4 ), operasi tegangan rendah (<0,4 V vs. Li/Li + ), cadangan yang melimpah, dan toksisitas yang rendah. [ 4 – 9 ] Namun, perubahan volume yang besar (≈280%) selama proses lithiation/delithiation membentuk retakan dan crazing pada elektroda Si, yang mengurangi kapasitas dan siklus hidupnya. [ 10 , 11 ] Kerugian lain dari Si sebagai material aktif adalah konduktivitas listriknya yang rendah (≈10 −3 S cm −1 ) dan koefisien difusi Li + (10 −14 –10 −13 cm 2 s −1 ). Kendala ini telah membatasi kinerja daya tinggi dan pemanfaatan kapasitas penuh elektroda Si di LIB. [ 11 – 14 ]
Untuk mengendalikan ekspansi volume selama lithiation, berbagai struktur berpori berbasis Si telah diusulkan sebagai bahan aktif untuk elektroda LIB. [ 6 , 9 – 11 , 15 – 52 ] Namun, rongga besar melemahkan kerangka struktur berpori, menghasilkan elektroda yang lebih rapuh dan sifat listrik, seperti kerapatan energi volumetrik dan siklus hidup, berkurang. [ 31 , 35 , 50 , 51 ] Rongga besar dan porositas tinggi juga memperlambat laju migrasi ion Li dan mengurangi kinerja laju. [ 35 ] Diameter partikel Si berpori (p-Si) juga memengaruhi karakteristik elektrokimia karena efisiensi Coulombik awal dan kapasitas spesifik elektroda menurun saat ukuran partikel bahan aktif meningkat. [ 41 ] Oleh karena itu, sintesis elektroda p-Si memerlukan pengoptimalan bentuk, ukuran, porositas, dan struktur rangka partikel untuk menyeimbangkan trade-off antara menekan ekspansi volume dan menurunkan kinerja elektroda. Lebih jauh lagi, elektroda komposit yang menggabungkan p-Si dengan unsur dan senyawa lain, seperti B, C, SiO 2 , dan Ge, telah dilaporkan menunjukkan karakteristik siklus yang sangat baik. Akan tetapi, unsur dan senyawa di atas memiliki kapasitas teoritis yang jauh lebih kecil daripada Si. Oleh karena itu, penyertaan unsur dan senyawa tersebut dapat mengurangi kapasitas elektroda. [ 26 , 43 , 46 , 52 ]
Untuk meningkatkan konduktivitas partikel Si, banyak penelitian telah mempertimbangkan melapisinya dengan bahan konduktif atau mendopingnya dengan pengotor, seperti boron (B), tembaga (Cu), dan fosfor (P), untuk mengurangi resistansi listrik Si. [ 6 , 10 , 11 , 19 , 22 , 23 , 25 , 26 , 28 , 32 , 35 – 37 , 40 , 43 , 47 , 51 , 53 – 69 ] Untuk aplikasi sebagai bahan aktif dalam elektroda, komposit yang dihasilkan harus memiliki sifat-sifat, seperti reaktivitas sedang dengan Li + , resistivitas elektronik rendah, dan sifat mekanik yang baik, untuk relaksasi tegangan dan stabilitas termodinamika. [ 59 ] Silikida, seperti VSi 2 /Si, FeSi 2 /Si, NiSi 2 / Si, MoSi 2 /Si, dan LaSi 2 /Si, telah menunjukkan hasil yang menjanjikan sebagai anoda LIB . [ 25 , 53 , 59 , 68 ] Silikida umumnya memiliki konduktivitas dan karakteristik laju yang lebih tinggi daripada Si, tetapi sifat elektrokimianya berbeda tergantung pada logam yang digunakan. [ 53 , 55 , 59 , 69 ]
Akhirnya, aplikasi elektroda berbasis Si yang lebih luas pada LIB berkapasitas besar memerlukan metode fabrikasi yang dapat diskalakan dengan hasil yang tinggi. [ 17 , 34 ] Metode paduan de-Al digunakan secara luas untuk mensintesis material p-Si karena biayanya yang relatif rendah dan persiapannya yang sederhana, [ 15, 19-22, 26, 28-30, 34, 37-42, 44, 45, 47-51 ] dan metode ini melibatkan penggunaan larutan etsa asam untuk secara istimewa melarutkan Al dari paduan Al – Si untuk membentuk partikel p – Si yang mempertahankan bentuk bubuknya. [ 20 , 26 , 30 , 37 , 38 , 41 , 42 , 50 , 51 ] Penelitian sebelumnya telah menunjukkan bahwa ukuran pori dan porositas partikel p-Si dapat disesuaikan dengan rasio Al/Si dalam paduan Al–Si. [ 50 ] Untuk mengoptimalkan struktur mikro partikel p-Si, struktur mikro bubuk prekursor Al–Si perlu dioptimalkan terlebih dahulu. Atomisasi gas adalah metode yang banyak digunakan untuk memproduksi bubuk logam dalam jumlah besar dengan struktur mikro yang seragam dan halus, dan laju pendinginannya yang tinggi memungkinkannya untuk menghasilkan bubuk logam yang terdiri dari larutan padat lewat jenuh. [ 70 – 74 ]
Dalam pekerjaan kami sebelumnya, partikel p-Si disintesis dengan etsa asam dari bubuk paduan Al–Si yang dibuat dengan atomisasi gas. Partikel p-Si menekan perubahan volume elektroda yang dihasilkan selama lithiasi, dan elektroda menunjukkan siklus hidup yang meningkat secara dramatis. [ 50 ] Namun, elektroda menunjukkan kinerja laju yang buruk dalam hal sifat elektrokimia karena konduktivitas Si yang buruk. Untuk meningkatkan kinerja laju, kami menggunakan pendekatan yang sama untuk membuat elektroda berbasis Si berpori dari silikida yang mengandung Nb dan V dan menyelidiki efek Nb dan V pada morfologi dan sifat elektrokimia bahan aktif. Partikel VSi 2 /Si berpori menunjukkan kinerja laju yang sangat baik karena dispersi VSi 2 yang sangat konduktif dan pori-pori halus (berukuran 5–200 nm), dan elektroda yang dibuat mempertahankan kapasitas pelepasan 1000 mAh g −1 selama 800 siklus. [ 51 ] An et al. melaporkan anoda p-Si berlapis karbon dengan kapasitas pelepasan 1271 mAh g −1 pada kerapatan arus 2100 mA g −1 setelah 1000 siklus untuk tingkat retensi kapasitas 90%. [ 36 ] Namun, sebagian besar penelitian tentang sifat elektrokimia elektroda berbasis Si hanya menguji hingga 500 siklus dan telah melaporkan kapasitas pelepasan 700–1846 mAh g −1 dan tingkat retensi kapasitas 33%–86% (Tabel S1 dan Gambar S1, Informasi Pendukung). [ 27 – 35 , 37 – 42 , 44 , 45 , 47 ]
Dalam studi ini, kami menyelidiki penambahan elemen transisi ke bubuk paduan Al–Si prekursor untuk lebih meningkatkan siklus dan kinerja laju partikel p-Si yang dihasilkan. Gambar 1 menunjukkan skema metode sintesis kami untuk p-Si menggunakan atomisasi gas dan etsa asam. Bubuk paduan Al–Si yang mengandung Mo dan Ti (Al 72,5 Si 25 Mo 2,5 dan Al 72,5 Si 25 Ti 2,5 ) disiapkan dengan atomisasi gas, dan kemudian, dietsa asam untuk mensintesis komposit p-Si (p-Mo(Al,Si) 2 @Si dan p-Ti(Al,Si) 2 @Si). Komposit p-Si kemudian digunakan untuk membuat elektroda, dan kinerja laju dan siklusnya diuji. Bubuk paduan Al 75 Si 25 yang diproduksi melalui atomisasi gas dietsa asam untuk menyiapkan partikel p-Si tanpa logam transisi, dan partikel-partikel ini kemudian dibandingkan dengan Si murni (Gambar S2, Informasi Pendukung).
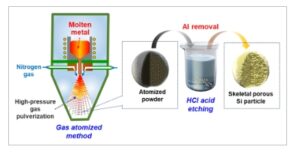
Gambar 1
Buka di penampil gambar
Kekuatan Gambar
Skema metode sintesis untuk partikel p-Si rangka: atomisasi gas bubuk prekursor diikuti oleh etsa asam dengan HCl untuk menghilangkan Al.
2 Hasil dan Pembahasan
2.1 Morfologi Partikel
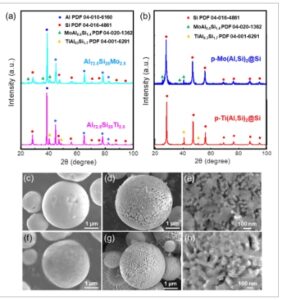
Gambar 2 a,b menunjukkan pola difraksi sinar-X (XRD) dari bubuk prekursor yang diatomisasi (Al 72,5 Si 25 Mo 2,5 dan Al 72,5 Si 25 Ti 2,5 ) dan partikel p-Si (p-Mo(Al,Si) 2 @Si dan p-Ti(Al,Si) 2 @Si), dan Gambar 2c–i mengilustrasikan gambar mikroskop elektron pemindaian (SEM) mereka. Bubuk prekursor yang diatomisasi memiliki fase Al (PDF 04-010-6160) dan Si (PDF no. 04-016-4861), dan bubuk Al 72,5 Si 25 Mo 2,5 memiliki fase MoAl 0,6 Si 1,4 (PDF no. 04-020-1362) sedangkan bubuk Al 72,5 Si 25 Ti 2,5 memiliki fase TiAl 0,3 Si 1,7 (PDF no. 04-001-6291). Partikel p-Si terutama terdiri dari fase Si dengan bidang kristal (111), (220), (311), (400), (331), (422), dan (511). Fasa MoAl 0,6 Si 1,4 dan TiAl 0,3 Si 1,7 dikonfirmasi dalam partikel p-Mo(Al,Si) 2 @Si dan p-Ti(Al,Si) 2 @Si, masing-masing. Paduan Al 72,5 Si 25 Mo 2,5 dan Al 72,5 Si 25 Ti 2,5 yang diatomisasi terdiri dari matriks Al dan silisida Si dan Mo(Al,Si) 2 atau Ti(Al,Si) 2 yang menyerupai rangka . Hasil XRD pada Gambar 2b menunjukkan bahwa puncak Al tidak lagi terdeteksi dalam p-Mo(Al,Si) 2 @Si dan p-Ti(Al,Si) 2 @Si setelah perlakuan asam, yang menunjukkan bahwa matriks Al telah larut sepenuhnya dan partikel silikon berpori terdiri dari silisida Si dan Mo(Al,Si) 2 atau Ti(Al,Si) 2 yang berbentuk rangka .
Gambar 2
Buka di penampil gambar
Kekuatan Gambar
Pola XRD dari a) serbuk Al 72.5 Si 25 Mo 2.5 dan Al 72.5 Si 25 Ti 2.5 dan b) partikel p-Mo(Al,Si) 2 @Si dan p-Ti(Al,Si) 2 @Si. Gambar SEM c) Al 72.5 Si 25 Mo 2.5 , d,e) p-Mo(Al,Si) 2 @Si, f) Al 72.5 Si 25 Ti 2.5 , dan g,h) p-Ti(Al,Si) 2 @Si.
Baik bubuk prekursor Al 72,5 Si 25 Mo 2,5 maupun Al 72,5 Si 25 Ti 2,5 yang diatomisasi terdiri dari partikel bulat berukuran ≈3 μm dengan permukaan halus dibandingkan dengan bubuk paduan Al 75 Si 25 (Gambar 2c,f , S3 dan S4, dan Tabel S2, Informasi Pendukung). Partikel p-Si juga berbentuk bulat, tetapi pori-pori dapat diamati pada permukaannya (Gambar 2d,e ,g,h, S5, Informasi Pendukung). Proses dealloying paduan Al–Si memungkinkan etsa asam klorida (HCl) untuk menyerang Al secara istimewa, yang mengarah pada pembentukan partikel p-Si yang mempertahankan bentuk bubuk. Persamaan berikut menunjukkan reaksi etsa dengan Al dan HCl. [ 20 ]
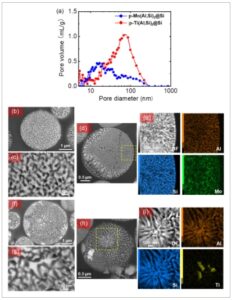
![]()
Gambar 3 menunjukkan morfologi partikel p-Mo(Al,Si) 2 @Si dan p-Ti(Al,Si) 2 @Si yang diperoleh melalui SEM penampang melintang, mikroskopi elektron transmisi, mikroskopi elektron transmisi pemindaian–pemindaian medan gelap annular sudut tinggi (STEM–HAADF), dan spektroskopi sinar-X dispersif energi (EDS) beserta distribusi ukuran pori dan luas permukaan spesifiknya (Gambar S6 dan Tabel S3, Informasi Pendukung). Karena silikida, seperti Mo(Al,Si) 2 dan Ti(Al,Si) 2 , stabil terhadap asam, mereka tidak larut. Hanya Al yang larut, dan area yang ditempatinya menjadi hampa. Luas permukaan dan volume pori masing-masing adalah 58,0 m 2 g −1 dan 0,225 mL g −1 untuk partikel p-Si, masing-masing 69,8 m 2 g −1 dan 0,378 mL g −1 untuk partikel p-Mo(Al,Si) 2 @Si, dan masing-masing 57,8 m 2 g −1 dan 0,669 mL g −1 untuk partikel p-Ti(Al,Si) 2 @Si. Pori-pori partikel p-Si lebih besar daripada yang dapat dianalisis dengan metode Brunauer–Emmett–Teller (BET); oleh karena itu, porositas dan distribusi ukuran pori diukur dengan porosimetri injeksi merkuri (MIP) (Gambar 3a , S7 dan Tabel S4, Informasi Pendukung). Tidak ada pori yang lebih besar dari 300 nm di semua partikel p-Si. Distribusi pori partikel p-Si memiliki rentang 20–250 nm dengan sebagian besar pori dalam rentang 150–200 nm. Partikel p-Mo(Al,Si) 2 @Si memiliki ukuran pori 10–250 nm dengan ukuran pori yang paling umum sekitar 20 nm. Partikel p-Ti(Al,Si) 2 @Si memiliki ukuran pori 5–200 nm dengan sebagian besar pori sekitar 80 nm. Mikrostruktur penampang dan peta unsur bubuk prekursor yang diatomisasi diperoleh menggunakan SEM dan EDS, masing-masing (Gambar S8 dan S9, Informasi Pendukung). Ukuran butiran kristal fase Al menurun dengan penambahan Mo dan Ti, dan fase Al dalam bubuk Al 72,5 Si 25 Mo 2,5 memiliki butiran kristal paling halus. Hal ini mungkin menjelaskan mengapa partikel p-Mo(Al,Si) 2 @Si memiliki pori-pori yang lebih kecil dibandingkan partikel p-Ti(Al,Si) 2 @Si (Gambar 3 dan S9, Informasi Pendukung). Partikel p-Si, p-Mo(Al,Si) 2 @Si, dan p-Ti(Al,Si) 2 @Si memiliki porositas masing-masing sebesar 63%, 46%, dan 63% (Tabel S4, Informasi Pendukung). Partikel p-Ti(Al,Si) 2 @Si sebagian besar mengandung makropori (50–200 nm), tetapi p-Mo(Al,Si) 2Partikel @Si mengandung mesopori (10–50 nm) selain makropori. Sementara itu, fase Al berukuran meso atau makro dalam bubuk paduan Al 72,5 Si 25 Mo 2,5 atau Al 72,5 Si 25 Ti 2,5 yang diatomisasi dilarutkan oleh HCl untuk membentuk mesopori atau makropori. (Gambar 3 dan S9, Informasi Pendukung).
Gambar 3
Buka di penampil gambar
Kekuatan Gambar
a) Distribusi ukuran pori partikel p-Mo(Al,Si) 2 @Si dan p-Ti(Al,Si) 2 @Si. Karakterisasi struktur partikel p-Mo(Al,Si) 2 @Si: b,c) SEM, d) STEM–HAADF, dan e) citra DF daerah titik-titik kuning pada (d) dan peta EDS daerah Al, Si, dan Mo. Karakterisasi struktur partikel p-Ti(Al,Si) 2 @Si: f,g) SEM, h) STEM–HAADF, dan i) citra DF daerah titik-titik kuning pada (h) dan peta EDS Al, Si, dan Ti.
2.2 Komposisi Fase
Dalam partikel p-Mo(Al,Si) 2 @Si, Si hadir sebagai cabang-cabang yang membentuk kerangka Si eutektik. Sementara itu, Al terlarut dalam kerangka Si eutektik, dan Mo hidup berdampingan dengan Al dalam kerangka Si eutektik. Pola XRD (Gambar 2b ) menunjukkan bahwa partikel p-Mo(Al,Si) 2 @Si terdiri dari fase Si eutektik dan silisida Mo(Al,Si) 2 . Dalam partikel p-Ti(Al,Si) 2 @Si, Si juga membentuk kerangka Si eutektik dan Al terdistribusi secara merata ke seluruh kerangka Si eutektik. Ti terdistribusi dalam partikel masif sementara Al dan Si berada dalam larutan padat. Pola XRD menunjukkan bahwa partikel p-Ti(Al,Si) 2 @Si merupakan silisida Ti(Al,Si) 2 yang menggumpal . Namun, karena tidak ada puncak yang terkait dengan senyawa Al–Ti yang terdeteksi dalam pola XRD, senyawa tersebut mungkin telah terlarut melalui etsa asam.
Diagram fase biner Al–Si (Gambar S10, Informasi Pendukung) menunjukkan bahwa paduan Al–Si adalah sistem eutektik di mana fase padat–larutan terdiri dari dua fase: Al dengan struktur fcc dan Si dengan struktur kubik intan. [ 75 ] Dalam keadaan kesetimbangan, paduan Al–Si memiliki komposisi eutektik Al–12,2 at% Si dan suhu eutektik 577 °C. Transformasi fase dan mikrostruktur pemadatan paduan Al–Si sangat bergantung pada jumlah Al dan Si, dan paduan tersebut didefinisikan sebagai hipoeutektik jika kandungan Si kurang dari 12,2 at% dan hipereutektik jika kandungan Si lebih dari 12,2 at%. [ 75 – 77 ] Pada komposisi eutektik, fase Si eutektik membentuk dendrit, dan mereka memadat dalam keadaan resin dari paduan cair pada suhu eutektik. Sementara itu, fase Al eutektik memadat di sekitar fase Si eutektik. Untuk komposisi hipoeutektik, fase Al primer membeku terlebih dahulu, kemudian fase Si eutektik membeku bersama dengan fase Al eutektik pada titik eutektik. Untuk komposisi hipereutektik, fase Si primer membeku terlebih dahulu dalam gumpalan, kemudian fase Al eutektik membeku bersama dengan fase Si eutektik pada titik eutektik. [ 75 ] Mikrostruktur paduan Al–Si (yaitu, morfologi fase Al dan Si) sangat bervariasi tergantung pada keadaan pemadatan. [ 75 – 81 ] Dalam kasus paduan biner Al–Si, reaksi eutektik terjadi pada kandungan Si yang lebih tinggi daripada 12,2 at% ketika paduan tersebut membeku dengan cepat dari logam cair ke keadaan superdingin, seperti dalam atomisasi gas. [ 82 ] Oleh karena itu, bubuk paduan Al–Si dengan komposisi hipereutektik yang dipadamkan oleh atomisasi gas ke komposisi mendekati eutektik diubah menjadi mikrostruktur yang tidak mengandung fase Si primer. [ 82 ] Untuk struktur pemadatan paduan biner Al–Si, laju pendinginan yang lebih cepat menghasilkan butiran kristal yang lebih halus untuk fase Al primer serta struktur mikro yang lebih halus untuk fase Si eutektik seperti dendrit. [ 80 ] Namun, struktur pemadatan paduan Al–Si dilaporkan berubah drastis tergantung pada elemen yang ditambahkan. [ 77 , 79 – 81 ]
Untuk menyelidiki struktur pemadatan serbuk paduan Al–Si yang didoping dengan Mo dan Ti, diagram fase untuk sistem Al–Si, Al–Si–Mo, dan Al–Si–Ti dalam keadaan setimbang dihitung berdasarkan data termodinamika dari literatur menggunakan perangkat lunak Thermo-Calc ( https://thermocalc.com ). Diagram fase dan data eksperimen kemudian digunakan untuk memprediksi diagram keadaan metastabil dari sistem Al–Si, Al–Si–Mo, dan Al–Si–Ti. [ 83 , 84 ] Diagram keadaan metastabil (garis putus-putus biru) dan diagram fase kesetimbangan (garis padat hitam) serbuk prekursor Al 75 Si 25 , Al 72,5 Si 25 Mo 2,5 , dan Al 72,5 Si 25 Ti 2,5 dibandingkan untuk memperoleh komposisi Al–(0–30 at% Si), Al–(0–40 at% Si)–2,5 at% Mo, dan Al–(0–40 at% Si)–2,5 at% Ti, masing-masing (Gambar S11–S13, Informasi Pendukung). Untuk pemadatan metastabil, titik eutektik (e′) sistem Al–Si–Mo diperkirakan mendekati Al–26 at% Si–2,5 at% Mo karena suhu eutektik paduan Al–Si menurun akibat supercooling dari atomisasi gas, yang menggeser komposisi eutektik ke arah konsentrasi Si yang lebih tinggi. [ 50 , 51 , 81 , 82 ] Untuk paduan biner Al–Si dengan komposisi hipoeutektik, Al primer membeku dari logam cair, kemudian Si eutektik seperti dendrit dan Al eutektik membeku di titik eutektik (e). [ 47 , 48 , 75 , 76 ] Demikian pula, morfologi kristalisasi Al 75 Si 25 yang diatomisasi diperoleh dengan membandingkan diagram metastabil (garis putus-putus biru) dan diagram kesetimbangan (garis padat hitam) dari sistem biner Al–Si (Gambar S11, Informasi Pendukung). Kedua sistem tersebut mengalami superdingin dalam keadaan metastabil, yang menurunkan suhu eutektik dan menggeser komposisi eutektik (titik) sistem biner dan terner ke dekat Al–20 pada% Si. [ 50 , 51 , 75 , 82 ] Karena Al 72,5 Si 25 Mo 2,5 dan Al 72,5 Si 25 Ti 2,5 mempunyai komposisi hipoeutektik, maka Mo(Al,Si) 2 dan Ti(Al,Si) 2fase-fase yang dipadatkan dari logam cair. Kemudian, fase Al primer dan fase Si eutektik seperti dendrit dipadatkan bersama dengan fase Al eutektik selama pendinginan. Spektrum EDS dan peta unsur menunjukkan bahwa Mo(Al,Si) 2 terdispersi halus dan seragam dalam bubuk Al 72,5 Si 25 Mo 2,5 yang diatomisasi sementara gumpalan Ti(Al,Si) 2 terdispersi dalam bubuk Al 72,5 Si 25 Ti 2,5 yang diatomisasi (Gambar S7, Informasi Pendukung). Ketika dipadatkan dalam keadaan setimbang, bubuk Al 72,5 Si 25 Mo 2,5 dan Al 72,5 Si 25 Ti 2,5 memiliki komposisi hipereutektik. Namun, pemadatan cepat melalui atomisasi gas mengubahnya menjadi komposisi hipoeutektik yang terdiri dari Mo(Al,Si) 2 atau Ti(Al,Si) 2 , Al primer, Al eutektik, dan fase Si eutektik seperti dendrit. [ 50 , 51 ] Spektrometri emisi optik plasma yang diinduksi (ICP-OES) menunjukkan bahwa partikel p-Mo(Al,Si) 2 @Si dan p-Ti(Al,Si) 2 @Si memiliki kandungan Al masing-masing sebesar 5,7 dan 4,0 at% (Tabel S5, Informasi Pendukung). Untuk sistem biner Al–Si pada kesetimbangan, Al memiliki kelarutan 1,5 at% dalam Si (Gambar S10, Informasi Pendukung), tetapi kelarutan meningkat dengan pendinginan cepat. [ 75 ] Analisis EDS dari partikel p-Mo(Al,Si) 2 @Si menunjukkan bahwa kerangka Si mengandung Al, Si, dan Mo (Gambar 3e ). Pemetaan unsur juga menunjukkan bahwa Al dan Mo terdistribusi secara seragam dalam fase Si eutektik seperti dendrit dari partikel p-Mo(Al,Si) 2 @Si. Dalam sistem Al–Si–Mo, Al memiliki batas kelarutan padat ≈2 at% dalam Si pada kesetimbangan (Gambar S12, Informasi Pendukung), tetapi batas tersebut meningkat menjadi ≈4 at% dengan pemadatan cepat (panah putus-putus merah pada Gambar S12, Informasi Pendukung). Untuk partikel p-Mo(Al,Si) 2 @Si, batas kelarutan padat Al dalam fase Si eutektik seperti dendrit meningkat menjadi sekitar 4 at% dengan pemadatan cepat. Dalam partikel p-Ti(Al,Si) 2 @Si, fase Ti(Al,Si) 2 yang menggumpal yang mengandung Al dideteksi bersama dengan fase Si eutektik seperti dendrit (Gambar 3idan S13, Informasi Pendukung). Oleh karena itu, bubuk prekursor yang diatomisasi menunjukkan peningkatan besar dalam jumlah Al yang terlarut dalam fase Si dan silikida karena pendinginan cepat dari atomisasi gas, dan Al tetap berada dalam Si eutektik dan silikida partikel p-Si bahkan setelah etsa asam. Pola XRD (Gambar 2b ) menunjukkan bahwa partikel p-Mo(Al,Si) 2 @Si dan p-Ti(Al,Si) 2 @Si masing-masing terdiri dari 10 dan 13 wt% silikida (Tabel S6, Informasi Pendukung). Komposisi dan kuantitas silikida dalam bahan aktif berbasis Si telah dilaporkan memengaruhi tidak hanya ekspansi elektroda selama lithiasi tetapi juga sifat elektrokimia, seperti kinerja laju dan siklus. [ 25 , 55 , 59 , 69 ] Sebagai alternatif, kami menggunakan bubuk paduan Al–Si yang dipadatkan dengan cepat melalui atomisasi gas untuk mendekati komposisi eutektik.
2.3 Kinerja Elektrokimia
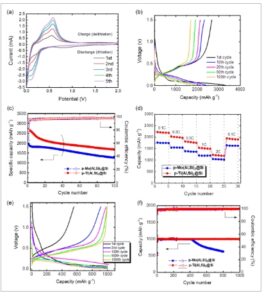
Gambar 4 menunjukkan kinerja elektrokimia dari elektroda p-Mo(Al,Si) 2 @Si, p-Ti(Al,Si) 2 @Si, dan elektroda Si murni yang telah disiapkan dan membandingkannya dengan elektroda Si murni curah dan p-Si tanpa elektroda logam transisi (Gambar S14–S17, Informasi Pendukung). [ 51 ] Voltametri siklik (CV) dilakukan pada laju pemindaian 0,1 mV s −1 dalam rentang potensial 0,005–2,0 V (Gambar 4a , S14 dan S15 Informasi Pendukung). Pada siklus pertama, puncak katoda lebar dideteksi pada ≈1,2 V untuk elektroda Si murni dan 0,8 V untuk elektroda p-Si, p-Mo(Al,Si) 2 @Si, dan p-Ti(Al,Si) 2 @Si. Ini disebabkan oleh perubahan arus yang berkaitan dengan lapisan antarmuka elektrolit padat (SEI) yang terbentuk pada permukaan elektroda sebagai akibat dari dekomposisi elektrolit. [ 22 ] Karena lapisan SEI yang stabil terbentuk pada siklus pertama, puncak-puncak ini tidak lagi terdeteksi sejak siklus kedua dan seterusnya. Semua elektroda menunjukkan kurva pemindaian katoda pada potensial lebih rendah dari 0,5 V, dengan penurunan arus tajam pada 0,005 V yang berhubungan dengan lithiasi Si. [ 40 ] Elektroda p-Si diaktifkan oleh siklus dengan arus katoda meningkat dari dua menjadi lima pemindaian pada kurang dari 0,5 V karena lithiasi. [ 43 ] Kurva pemindaian anodik untuk proses delithiasi menunjukkan dua puncak pada 0,35 dan 0,55 V yang menunjukkan proses konversi dari Li x Si menjadi senyawa Li–Si amorf dan pembentukan Si amorf, masing-masing. [ 45 ] Untuk elektroda p-Si, puncak anodik ini meningkat dengan jumlah siklus. Puncak pada kurva pemindaian anodik dari elektroda Si murni tidak jelas pada siklus awal, tetapi sama dengan elektroda p-Si, p-Mo(Al,Si) 2 @Si, dan p-Ti(Al,Si) 2 @Si pada ≈0,35 dan ≈0,55 V dari siklus kedua dan seterusnya (Gambar 4a , S14a dan S15a,b, Informasi Pendukung).
Gambar 4
Buka di penampil gambar
Kekuatan Gambar
Sifat elektrokimia elektroda p-Mo(Al,Si) 2 @Si dan p-Ti(Al,Si) 2 @Si. a) Kurva arus-tegangan untuk elektroda p-Ti(Al,Si) 2 @Si selama lima siklus pengisian-pengosongan. b) Profil tegangan untuk elektroda p-Ti(Al,Si) 2 @Si (0,005–1,5 V) pada laju C 0,1 C. c) Kapasitas dan efisiensi Coulombik versus jumlah siklus pada tegangan 0,005–1,5 V dan laju C 0,1 C. d) Kapasitas elektroda p-Mo(Al,Si) 2 @Si dan p-Ti(Al,Si) 2 @Si selama lima siklus pengisian–pengosongan pada laju C 0,1 dan 2 C. e) Profil tegangan untuk p-Ti(Al,Si) 2 @Si dengan siklus pengisian–pengosongan pada laju C 0,2 C dan kapasitas pengosongan konstan 1000 mAh g −1 . f) Kurva kapasitas–siklus elektroda p-Mo(Al,Si) 2 @Si dan p-Ti(Al,Si) 2 @Si pada laju C 0,2 C dan kapasitas pengisian konstan 1000 mAh g −1 .
Profil voltase elektroda diperoleh selama uji siklus galvanostatik pada laju C 0,1 C (Gambar 4b untuk elektroda p-Ti(Al,Si) 2 @Si; Gambar S14b dan S15c,d, Informasi Pendukung untuk elektroda Si murni, p-Si, dan p-Mo(Al,Si) 2 @Si). Banyak penelitian telah melaporkan bahwa kapasitas elektroda Si massal menurun cepat dengan siklus pengisian–pengosongan. [ 6 , 7 , 9 , 10 ] Kapasitas pengosongan elektroda Si murni mencapai 2804 mAh g −1 pada siklus awal tetapi menurun cepat dengan lebih banyak siklus (Gambar S15c dan S16, Informasi Pendukung). Efisiensi Coulombik adalah 77%–89% dalam sepuluh siklus pertama, tetapi kapasitas pengosongan menurun cepat dengan siklus selanjutnya dan mencapai 165 mAh g −1 setelah 50 siklus. Penurunan kapasitas dapat dikaitkan dengan perubahan besar dalam volume bahan aktif dengan lithiation dan delithiation berulang yang membuat elektroda tidak dapat mempertahankan strukturnya. [ 6 , 7 , 9 , 10 ] Plateau lithiation dalam profil tegangan elektroda p-Si, p-Mo(Al,Si) 2 @Si, dan p-Ti(Al,Si) 2 @Si mirip dengan elektroda Si murni. Profil pengisian-pelepasan elektroda p-Si, p-Mo(Al,Si) 2 @Si, dan p-Ti(Al,Si) 2 @Si hampir sama dengan elektroda Si murni. [ 6 ] Plateau lithiation dalam profil pengisian–pengosongan elektroda p-Si, p-Mo(Al,Si) 2 @Si, dan p-Ti(Al,Si) 2 @Si pada siklus pertama serupa dengan elektroda Si murni, yang mungkin karena Si bereaksi dengan Li untuk membentuk fase Li x Si amorf. [ 85 ] Pada siklus awal, kapasitas pengosongan dan efisiensi Coulombik elektroda p-Si masing-masing adalah 2169 mAh g −1 dan 68,6% untuk p-Si, masing-masing 1968 mAh g −1 dan 64,5% untuk p-Mo(Al,Si) 2 @Si, dan masing-masing 2681 mAh g −1 dan 79,8% untuk p-Ti(Al,Si) 2 @Si. Rendahnya efisiensi Coulombik elektroda p-Si pada siklus awal mungkin disebabkan oleh terbentuknya lapisan SEI dan terjadinya reaksi ireversibel. [ 25 ]Elektroda p-Si memiliki luas permukaan yang jauh lebih besar daripada elektroda Si murni, sehingga jumlah reaksi ireversibel yang berkontribusi pada pembentukan lapisan SEI lebih besar. [ 37 ] Selain itu, efisiensi Coulomb mungkin telah diturunkan oleh reaksi ireversibel yang menyertai lithiasi pengikat polimer. [ 20 ] Partikel p-Mo(Al,Si) 2 @Si memiliki luas permukaan yang lebih besar daripada partikel p-Si dan p-Ti(Al,Si) 2 @Si; oleh karena itu, mereka mungkin telah membentuk lapisan SEI yang lebih tebal selama pengisian dan pengosongan pertama (Tabel S3, Informasi Pendukung). Spektroskopi impedansi elektrokimia (EIS) dilakukan untuk mengevaluasi efek Mo dan Ti pada sifat elektrokimia elektroda p-Mo(Al,Si) 2 @Si dan p-Ti(Al,Si) 2 @Si. Seperti yang ditunjukkan pada Gambar S17, Informasi Pendukung, partikel p-Mo(Al,Si) 2 @Si menunjukkan resistansi lapisan SEI tertinggi (R SEI ) di antara semua partikel p-Si. Oleh karena itu, efisiensi Coulombik awal yang lebih rendah dari elektroda p-Mo(Al,Si) 2 @Si dibandingkan dengan elektroda p-Si dan p-Ti(Al,Si) 2 @Si dapat dikaitkan dengan lapisan SEI yang terbentuk selama siklus pengisian-pengosongan pertama.
Sebaliknya, efisiensi Coulombik elektroda p-Si meningkat pesat dalam 20 siklus berikutnya hingga mencapai 97,1%–98,7% untuk p-Si, 92,9%–97,0% untuk p-Mo(Al,Si) 2 @Si, dan 95,2%–96,8% untuk p-Ti(Al,Si) 2 @Si. Setelah 100 siklus, kapasitas pelepasan elektroda p-Si masing-masing adalah 1906, 1262, dan 1683 mAh g −1 , dan efisiensi Coulombik meningkat lebih lanjut hingga masing-masing 97,7%–99,5%, 96,9%–98,2%, dan 96,9%–98,8%. Dengan lebih banyak siklus, kapasitas elektroda p-Si, p-Mo(Al,Si) 2 @Si, dan p-Ti(Al,Si) 2 @Si terus menurun karena litiasi dan delitiasi. Di antara elektroda, p-Si menunjukkan kapasitas pelepasan terbesar setelah 100 siklus. Namun, elektroda p-Si tidak menunjukkan tanda-tanda degradasi cepat, dan setelah 100 siklus, elektroda p-Ti(Al,Si) 2 @Si memiliki kapasitas lebih besar daripada elektroda p-Mo(Al,Si) 2 @Si, yang menunjukkan bahwa elektroda tersebut memiliki karakteristik siklus yang baik.
Studi kami baru-baru ini menunjukkan bahwa elektroda p-Si terdoping V atau Nb memiliki kapasitas pelepasan yang lebih kecil daripada elektroda p-Si tak terdoping pada siklus awal, yang disebabkan oleh silikida logam transisi memiliki kapasitas pelepasan yang jauh lebih kecil daripada Si murni. [ 51 ] Lebih lanjut, Entwistle et al. melaporkan bahwa silikon mesopori yang disiapkan dengan metode reduksi termal magnesium memiliki kapasitas 2170 mAh g −1 setelah 100 siklus. [ 8 ] Elektroda p-Mo(Al,Si) 2 @Si dan p-Ti(Al,Si) 2 @Si memiliki kapasitas yang lebih rendah daripada kapasitas yang dilaporkan Entwistle et al. untuk elektroda Si mesopori. Kapasitas pelepasan yang lebih rendah untuk elektroda p-Mo(Al,Si) 2 @Si dibandingkan dengan elektroda p-Ti(Al,Si) 2 @Si mungkin disebabkan oleh banyaknya Al yang terlarut dalam kerangka Si (Tabel S5, Informasi Pendukung). Dalam pengujian siklus pengisian-pengosongan, elektroda ambruk karena Si berulang kali mengembang dan menyusut akibat litiasi dan delitiasi. Setelah 50 siklus, kapasitas elektroda Si murni menurun hingga ≈1/20 dari kapasitas awal. Namun, elektroda p-Mo(Al,Si) 2 @Si dan p-Ti(Al,Si) 2 @Si mempertahankan efisiensi Coulombik lebih dari 96% setelah 20 siklus dan kapasitas pengosongan masing-masing sebesar 1262 dan 1683 mAh g −1 setelah 100 siklus. Silikida yang menggabungkan logam tanah jarang atau logam transisi dengan silikon (misalnya, CrSi 2 , FeSi 2 , LaSi 2 , MmSi 2 , MoSi 2 , TiSi 2 , dan VSi 2 ) sebelumnya telah diusulkan sebagai bahan aktif untuk anoda LIB, [ 49 , 51 , 55 , 57 , 58 ] dan reaksi berikut telah diusulkan untuk lithiasi silisida logam (MSi 2 , M = Fe, La, Mn, dan V): [ 53 ]
![]()
Akan tetapi, elektroda berbasis silisida tersebut memiliki kapasitas penyimpanan Li yang rendah, yang secara signifikan menurunkan kapasitas pelepasannya dibandingkan dengan elektroda Si murni. Untuk elektroda berbasis silisida tersebut, x memiliki nilai 0,1–0,3. Sebagai contoh, Usui et al. melaporkan elektroda LaSi 2 dengan kapasitas pelepasan hanya 45 mAh g −1 , yang kira-kira satu orde besaran kurang dari kapasitas teoritis anoda grafit (yaitu, 372 mAh g −1 ). [ 53 ] Courtel et al. melaporkan bahwa MoSi 2 memiliki kapasitas teoritis 804 mAh g −1 dan membuat elektroda MoSi 2 dengan kapasitas pelepasan awal 450 mAh g −1 , tetapi menurun menjadi 75 mAh g −1 setelah 20 siklus pengisian-pengosongan pada 60 °C. [ 54 ] Lee et al. mempelajari efek kandungan Ti pada kapasitas pelepasan dan sifat siklus film tipis Si–Ti dan melaporkan kapasitas spesifik teoritis dan eksperimental sekitar 1500 dan 500 mAh g −1 , masing-masing, untuk silisida Ti(Al,Si) 2 (yaitu, paduan TiAl 0,3 Si 1,7 ). [ 58 ] Untuk elektroda p-Si, Al terlarut dapat memengaruhi kapasitas pelepasan. [ 50 ] Oleh karena itu, kapasitas pelepasan awal yang lebih rendah dari elektroda p-Mo(Al,Si) 2 @Si dan p-Ti(Al,Si) 2 @Si dibandingkan dengan elektroda Si murni dapat dikaitkan dengan keberadaan fase Al larutan padat dan silisida (Tabel S5 dan S6, Informasi Pendukung).
2.4 Nilai Kinerja
Setelah 20 siklus pengisian-pengosongan pada laju C 0,1 C, kinerja laju elektroda p-Si, p-Mo(Al,Si) 2 @Si, dan p-Ti(Al,Si) 2 @Si diuji selama lima siklus masing-masing pada laju C 0,2, 0,5, 1, dan 2 C. Gambar 4d menunjukkan kemampuan laju elektroda p-Mo(Al,Si) 2 @Si dan p-Ti(Al,Si) 2 @Si. Karakteristik laju elektroda p-Si juga ditunjukkan sebagai perbandingan (Gambar S18, Informasi Pendukung). [ 51 ] Elektroda p-Ti(Al,Si) 2 @Si mencapai kapasitas reversibel rata-rata 2174, 1970, 1744, 1468, dan 1332 mAh g −1 pada laju C masing-masing 0,1, 0,2, 0,5, 1, dan 2 C, dan kapasitas pelepasan 1921 mAh g −1 ketika laju C dikembalikan ke 0,1 C. Sementara itu, elektroda p-Mo(Al,Si) 2 @Si mencapai kapasitas reversibel 1719, 1523, 1349, 1175, dan 1139 mAh g −1 pada laju C masing-masing 0,1, 0,2, 0,5, 1, dan 2 C, dan kapasitas pelepasan 1633 mAh g −1 ketika laju C dikembalikan ke 0,1 C. Laju C dikembalikan ke 0,1 C. Kapasitas pelepasan dan efisiensi Coulombik elektroda p-Si setelah 100 siklus pada laju 0,1 C masing-masing adalah 1906 mAh g −1 dan 98,0%. Namun, peningkatan laju menjadi 2 C menyebabkan kapasitas pelepasan menurun dengan cepat menjadi 589 mAh g −1 . Sebaliknya, efisiensi Coulombik dan kapasitas pelepasan elektroda p-Ti(Al,Si) 2 @Si setelah 100 siklus pada laju 0,1 C masing-masing adalah 99,0% dan 1683 mAh g −1 , dan kapasitas pelepasan menurun menjadi 1332 mAh g −1 pada laju 2 C. Dengan demikian, penambahan Ti ditemukan sangat meningkatkan kinerja laju elektroda p-Si.
EIS digunakan untuk mengevaluasi efek Mo dan Ti pada kinerja laju elektroda p-Mo(Al,Si) 2 @Si dan p-Ti(Al,Si) 2 @Si. Plot Nyquist dari elektroda p-Si, p-Mo(Al,Si) 2 @Si, dan p-Ti(Al,Si) 2 @Si dibandingkan dengan elektroda Si murni (Gambar S17, Informasi Pendukung). Data impedansi digunakan untuk membangun model rangkaian ekivalen yang dioptimalkan dan menyesuaikan hasil resistansi SEI (R SEI ) dan resistansi transfer muatan (R CT ) (sisipan Gambar 4e ). [ 35 , 51 , 86 ] Elektroda Si murni memiliki R CT sebesar 39 Ω, tetapi elektroda p-Si, p-Mo(Al,Si) 2 @Si, dan p-Ti(Al,Si) 2 @Si memiliki R CT sebesar 21, 15, dan 6 Ω, yang menunjukkan bahwa silikida sangat meningkatkan kapasitas transpor muatan. Elektroda p-Ti(Al,Si) 2 @Si memiliki R CT yang lebih kecil daripada elektroda p-Si dan p-Mo(Al,Si) 2 @Si. Elektroda p-Si, p-Mo(Al,Si) 2 @Si, dan p-Ti(Al,Si) 2 @Si memiliki nilai R SEI masing-masing sebesar 3, 10, dan 9 Ω, yang lebih besar daripada nilai 1 Ω untuk elektroda Si murni. Porositas yang lebih tinggi dari partikel p-Si, p-Mo(Al,Si) 2 @Si, dan p-Ti(Al,Si) 2 @Si meningkatkan luas permukaan lapisan SEI, yang meningkatkan R SEI . Karena kinerja laju elektroda terkait dengan nilai resistansinya, elektroda p-Ti(Al,Si) 2 @Si menunjukkan kinerja laju yang lebih baik daripada elektroda p-Si dan p-Mo(Al,Si) 2 @Si.
Kinerja Siklus 2.5
Kapasitas elektroda Si dibatasi oleh ekspansi volume material aktif dengan lithiation. [ 7 ] Wada et al. mensintesis struktur Si nanopori 3D yang berdiri sendiri dengan dealloying dan melaporkan bahwa kapasitasnya tidak memburuk bahkan setelah 1500 siklus pengisian-pengosongan pada kapasitas konstan 1000 mAh g −1 . [ 18 ] Thakur et al. memproduksi partikulat silikon makropori menggunakan poliakrilonitril pirolisis, etsa wafer silikon, dan pemrosesan ultrasonik yang mempertahankan kapasitas 1000 mAh g −1 bahkan setelah 600 siklus, [ 87 ] yang hampir tiga kali lipat dari anoda grafit yang umum digunakan dalam LIB. Di sini, kinerja siklus elektroda p-Mo(Al,Si) 2 @Si dan p-Ti(Al,Si) 2 @Si diselidiki melalui uji siklus pengisian-pengosongan pada kapasitas konstan 1000 mAh g −1 dan laju C 0,2 C dan dibandingkan dengan elektroda Si murni dan p-Si. [ 51 ] Kurva kapasitas-siklus dan profil kapasitas-tegangan juga diperoleh (Gambar 4e,f , S19 dan S20, Informasi Pendukung). Elektroda Si murni memiliki efisiensi Coulombik sebesar 60,2% dan kapasitas pengosongan sebesar 603 mAh g −1 pada siklus pertama, yang masing-masing meningkat menjadi 92,9% dan 929 mAh g −1 , pada siklus kedua. Hingga 40 siklus, elektroda Si murni memiliki efisiensi Coulombik sebesar 95,6%–97,2% dan kapasitas pelepasan sebesar 957–973 mAh g −1 . Namun, efisiensi Coulombik dan kapasitas pelepasan menurun tajam setelah 40 siklus (Gambar S20a,c, Informasi Pendukung). Ini mungkin karena struktur elektroda runtuh saat material aktif Si berulang kali mengembang dan berkontraksi dengan litiasi dan delitiasi selama siklus pengisian–pengosongan. Untuk elektroda p-Si, p-Mo(Al,Si) 2 @Si, dan p-Ti(Al,Si) 2 @Si (Gambar 4e , S19 dan S20b,c, Informasi Pendukung), voltase yang terkait dengan litiasi menurun setelah 100 siklus. Kapasitas pelepasan elektroda p-Si dan p-Mo(Al,Si) 2 @Si menurun setelah 250 dan 400 siklus, masing-masing; Namun, elektroda p-Ti(Al,Si) 2 @Si mempertahankan kapasitas pelepasan 1000 mAh g −1 hingga 1000 siklus. Dalam lima siklus pertama, reaksi ireversibel terjadi karena pembentukan lapisan SEI pada antarmuka antara elektroda dan elektrolit. Elektroda p-Ti(Al,Si) 2 @Si memiliki efisiensi Coulombik yang melebihi 97,9% setelah enam siklus pada kapasitas pelepasan 1000 mAh g −1Elektroda p-Ti(Al,Si) 2 @Si mampu mempertahankan kapasitas yang stabil selama sejumlah besar siklus karena perubahan volume bahan aktifnya selama litiasi dan delitiasi kecil.
Untuk memperjelas hubungan antara jumlah siklus pengisian-pengosongan dan struktur elektroda, anoda dilepaskan dari sel baterai setelah pengujian siklus pengisian-pengosongan pada kapasitas pengosongan konstan 1000 mAh g −1 untuk menyelidiki perubahan dalam struktur. Gambar 5 dan 6 menggambarkan gambar SEM penampang elektroda p-Mo(Al,Si) 2 @Si dan p-Ti(Al,Si) 2 @Si sebelum dan sesudah pengujian siklus. Gambar S21, Informasi Pendukung menunjukkan peta EDS-nya. Gambar SEM penampang dan peta EDS elektroda Si murni dan p-Si sebelum dan sesudah pengujian siklus juga ditampilkan untuk perbandingan (Gambar S22–S24, Informasi Pendukung). [ 51 ] Setelah 800 siklus, ketebalan elektroda Si murni meningkat sekitar 300% dari 20 menjadi 56 μm. Siklus pengisian-pengosongan berulang menyebabkan bahan aktif elektroda Si murni mengembang selama litiasi dan menyusut selama delitiasi, yang menghancurkan dan melumatkan partikel Si dan menyebabkan bahan aktif tidak dapat mempertahankan ukuran awalnya. Kapasitas pelepasan menurun karena elektroda tidak dapat mempertahankan strukturnya. Setelah 800 siklus, ketebalan elektroda p-Si meningkat sebesar 221% (24–53 μm) untuk p-Si dan 225% (20–45 μm) untuk p-Mo(Al,Si) 2 @Si. Setelah 1000 siklus, ketebalan elektroda p-Ti(Al,Si) 2 @Si hanya meningkat sebesar 189% dari 28 menjadi 53 μm. Ketebalan elektroda p-Si, p-Mo(Al,Si) 2 @Si, dan p-Ti(Al,Si) 2 @Si meningkat karena kapasitasnya menurun. Wada dkk. memperkirakan bahwa batas akomodasi volume ideal (V A.L. ) partikel p-Si dengan porositas 60,4% adalah 253%. [ 18 ] Partikel p-Ti(Al,Si) 2 @Si memiliki porositas 63% (Tabel S4, Informasi Pendukung), sehingga peningkatan volume elektroda setelah 1000 siklus kurang dari V A.L. . Sebaliknya, partikel p-Mo(Al,Si) 2 @Si memiliki porositas 46%, dan peningkatan volume lebih besar dari V A.L. , yang akan menyebabkan elektroda kolaps. Partikel p-Si memiliki ukuran ≈3 μm sebelum uji siklus, dan mempertahankan bentuk bulat dari bubuk prekursor yang diatomisasi (Gambar 2 ). Tidak ada partikel p-Ti(Al,Si) 2 @Si yang berukuran 5 μm atau lebih besar (Gambar 6dan S21d, Informasi Pendukung), yang menunjukkan bahwa ekspansi yang disebabkan oleh lithiasi ditekan dan membantu menjelaskan peningkatan kinerja siklus. Setelah uji siklus, partikel Si dari elektroda Si murni dihaluskan dan dicampur dengan aditif konduktif (karbon hitam) dan pengikat (Gambar S24b, Informasi Pendukung). Bahan aktif dari elektroda p-Mo(Al,Si) 2 @Si dan p-Ti(Al,Si) 2 @Si masih terpisah dari pengikat atau karbon hitam setelah uji siklus (Gambar S21b,d, Informasi Pendukung). Namun, hampir tidak ada rongga yang diamati dalam elektroda p-Si setelah uji siklus (Gambar S23b dan S24d, Informasi Pendukung), yang mempertahankan keadaan yang mirip dengan elektroda Si murni. Sebaliknya, elektroda p-Ti(Al,Si) 2 @Si masih memiliki banyak rongga, dan ukurannya jauh lebih besar daripada rongga dalam elektroda p-Mo(Al,Si) 2 @Si (Gambar S21, Informasi Pendukung). Hasil-hasil ini menunjukkan bahwa elektroda p-Mo(Al,Si) 2 @Si memiliki kapasitas yang lebih rendah setelah 400 siklus pengisian-pengosongan sedangkan elektroda p-Ti(Al,Si) 2 @Si mempertahankan kinerja siklus yang sangat baik.

Gambar 5
Buka di penampil gambar
Kekuatan Gambar
Ekspansi elektroda setelah uji siklus pengisian-pengosongan pada 1000 mAh g −1 . Gambar SEM penampang elektroda p-Mo(Al,Si) 2 @Si a) sebelum dan b) setelah 800 siklus dan elektroda p-Ti(Al,Si) 2 @Si c) sebelum dan d) setelah 1000 siklus.

Gambar 6
Buka di penampil gambar
Kekuatan Gambar
Gambar SEM penampang elektroda p-Si dengan kapasitas 1000 mAh g −1 : a) p-Mo(Al,Si) 2 @Si setelah 800 siklus dan b) p-Ti(Al,Si) 2 @Si setelah 1000 siklus.
3 Kesimpulan
Bubuk prekursor Al 72,5 Si 25 Mo 2,5 dan Al 72,5 Si 25 Ti 2,5 disintesis melalui atomisasi gas dan dietsa asam untuk memperoleh partikel komposit p-Si. Partikel p-Mo(Al,Si) 2 @Si memiliki porositas 46%, sedangkan partikel p-Ti(Al,Si) 2 @Si memiliki porositas 63%, dan ukuran pori berkurang dengan penambahan Mo atau Ti. Partikel p-Mo(Al,Si) 2 @Si memiliki pori yang lebih halus daripada partikel p-Si yang tidak terdoping dan memiliki mesopori (10–50 nm) dan makropori (50–200 nm). Dalam uji siklus pengisian-pengosongan pada suhu 0,1 C, elektroda p-Mo(Al,Si) 2 @Si memiliki kapasitas pengosongan awal sebesar 1968 mAh g −1 yang menurun menjadi 1262 mAh g −1 setelah 100 siklus serta efisiensi Coulombik lebih dari 97%. Partikel p-Ti(Al,Si) 2 @Si memiliki pori makro (50–200 nm), dan elektroda yang sesuai memiliki kapasitas pengosongan awal sebesar 2681 mAh g −1 yang menurun menjadi 1683 mAh g −1 setelah 100 siklus serta efisiensi Coulombik lebih dari 97%. Elektroda p-Ti(Al,Si) 2 @Si juga menunjukkan kinerja laju yang sangat baik: ia memiliki R CT yang lebih kecil daripada elektroda p-Mo(Al,Si) 2 @Si, dan ia memiliki kapasitas reversibel sebesar 1332 mAh g −1 pada laju C 2 C serta kapasitas pelepasan sebesar 1000 mAh g −1 untuk 1000 siklus pada laju C 0,2 C. Makropori dalam partikel p-Ti(Al,Si) 2 @Si bertindak sebagai penyangga untuk menekan ekspansi volume selama litiasi sementara Ti(AlSi) 2 @Si meningkatkan konduktivitas listrik, yang meningkatkan kinerja laju dan siklus. Metode sintesis yang dikembangkan dapat ditingkatkan secara industri, dan kinerja siklus dan laju yang sangat baik dari partikel p-Ti(Al,Si) 2 @Si menjadikannya bahan aktif yang menarik untuk LIB berkapasitas tinggi dan berumur panjang.
4 Bagian Eksperimen
Serbuk Al 75 Si 25 , Al 72,5 Si 25 Mo 2,5 , dan Al 72,5 Si 25 Ti 2,5 disiapkan dengan atomisasi gas (Gambar S25, Informasi Pendukung), yang melibatkan penggunaan gas nitrogen bertekanan untuk mendispersikan logam cair yang kemudian didinginkan dengan cepat hingga memadat menjadi partikel. [ 50 , 51 , 70 – 73 ] Sekitar 1 kg masing-masing Al, Si, Mo, dan Ti ditempatkan dalam wadah grafit di dalam ruang berisi nitrogen dan dicairkan melalui pemanasan induksi. Paduan cair dengan komposisi Al 75 Si 25 , Al 72,5 Si 25 Mo 2,5 , dan Al 72,5 Si 25 Ti 2,5 masing-masing dilewatkan melalui nosel dan disemprotkan oleh alat penyemprot. [ 50 , 51 , 71 , 74 ] Komposisi serbuk Al 75 Si 25 , Al 72,5 Si 25 Mo 2,5 , dan Al 72,5 Si 25 Ti 2,5 ditetapkan oleh ICP-OES sebagai Al–24,8 at% Si (yaitu, Al–25,5 wt% Si), Al–24,4 at% Si–2,45 at% Mo (yaitu, Al–23,7 wt% Si–8,12 wt% Mo), dan Al–24,7 at% Si–2,54 at% Ti (yaitu, Al–25,0 wt% Si–4,37 wt% Ti), masing-masing (Tabel S7, Informasi Pendukung). Saringan digunakan untuk mengatur distribusi ukuran partikel serbuk Al 75 Si 25 , Al 72,5 Si 25 Mo 2,5 , dan Al 72,5 Si 25 Ti 2,5 . SEM digunakan untuk mengamati serbuk Al 75 Si 25 , Al 72,5 Si 25 Mo 2,5 , dan Al 72,5 Si 25 Ti 2,5 yang diatomisasi (Gambar S3, Informasi Pendukung), dan difraksi dan hamburan laser digunakan untuk mengukur distribusi ukuran partikel (Gambar S4, Informasi Pendukung). Parameter D10, D50, dan D90 ditetapkan sebagai ukuran partikel yang lebih besar dari 10%, 50%, dan 90%, masing-masing, dari semua partikel. Al 75 Si 25 , Al 72,5 Si 25 Mo 2,5 , dan Al 72,5 Si 25 Ti 2,5 yang diatomisasiserbuk memiliki nilai D50 masing-masing sebesar 3,25, 2,89, dan 2,74 μm (Tabel S2, Informasi Pendukung). Partikel Si murni yang diperoleh dari Kojundo Chemical Laboratory Co., Ltd. digunakan sebagai pembanding (Gambar S2, Informasi Pendukung).
Al dihilangkan dari serbuk Al 75 Si 25 , Al 72,5 Si 25 Mo 2,5 , dan Al 72,5 Si 25 Ti 2,5 yang diatomisasi dengan etsa asam untuk menyiapkan partikel komposit p-Si p-Mo(Al,Si) 2 @Si dan p-Ti(Al,Si) 2 @Si, masing-masing (Gambar 1 ). Sekitar 20 g serbuk prekursor yang diatomisasi (yaitu, Al 72,5 Si 25 Mo 2,5 atau Al 72,5 Si 25 Ti 2,5 ) ditambahkan ke dalam campuran 600 mL air dan 50 mL 12 mol L −1 HCl, yang dibiarkan selama 15 menit pada suhu 25 °C. Proses penambahan 50 mL 12 mol L −1 HCl dan menunggu 15 menit diulang tiga kali lagi setelah itu campuran diaduk pada suhu 90 °C selama 1 jam. Setelah pengetsaan asam selesai, partikel dicuci dengan air ultramurni, disaring, dan dikeringkan vakum pada suhu 50 °C selama 10 jam dalam tanur listrik. [ 50 , 51 ]
Struktur kristal ditentukan dengan XRD (Rigaku Ultima IV) menggunakan radiasi Cu-Kα pada laju pemindaian 20° min −1 pada rentang 2θ 20°–100°. Morfologi dan pemetaan unsur bubuk yang diatomisasi dan partikel p-Si diamati dan dianalisis melalui SEM/EDS (ZEISS GeminiSEM 460, Hitachi Regulus 8230), STEM/EDS (JEOL JEM-2100 F). Distribusi ukuran pori dan luas permukaan spesifik partikel p-Si dianalisis dengan metode BET (Quantachrome Quadrasorb SI) dan model Barrett–Joynes–Halenda. Karena penggunaan metode BET untuk mengukur ukuran pori 100 nm atau lebih merupakan tantangan, ukuran pori dan distribusi partikel p-Si diukur dengan MIP (Quantachrome PoreMaster 60GT).
Elektroda dibuat dengan mencampur setiap bahan aktif dengan karbon hitam dan pengikat polimida untuk membentuk bubur dengan rasio berat 60:20:20. Bubur tersebut diaplikasikan pada foil Cu, dipanaskan hingga 420 °C dalam tanur listrik, dan dikeringkan selama 30 menit dalam atmosfer argon inert. Jumlah bahan aktif yang dimuat pada setiap elektroda adalah 0,60–1,6 mg cm −2 . Elektroda lawan terbuat dari Li, pemisah adalah membran mikropori polipropilena dan elektrolitnya adalah 1 mol L −1 LiPF 6 (rasio volume 1,5:1,5:4:3) yang terdiri dari campuran etilena karbonat, fluoroetilena karbonat, dimetil karbonat, dan etil metil karbonat. Sifat elektrokimia dievaluasi dengan membuat sel tipe sandwich. CV dilakukan dengan menggunakan potensiostat multisaluran VMP-3 (Bio-Logic) pada rentang tegangan 0,005–2,0 V (vs. Li/Li + ) pada laju pindai 0,1 mV s −1 , dan EIS dilakukan antara 10 5 dan 0,01 Hz. Performa laju dan siklus dievaluasi dengan melakukan uji siklus galvanostatik pada rentang 0,005–1,5 V pada suhu 20–25 °C menggunakan konverter analog-ke-digital (ADC-01, Aska Electronics Corp.). Kepadatan arus ditetapkan sebesar 3600 mA g −1 pada laju C 1 C. Uji kemampuan laju dilakukan pada laju C 0,1 C untuk lima siklus pertama dan kemudian memvariasikan laju C dalam rentang 0,1–2 C setiap lima siklus setelahnya. Pengujian siklus pengisian-pengosongan galvanostatik dilakukan pada kapasitas pengisian konstan 1000 mAh g −1 dan laju C 0,2 C.

