
Abstrak
Elektrolisis air membran pertukaran anion (AEM) menjanjikan produksi hidrogen hijau. Salah satu tantangan utamanya adalah persiapan elektroda yang sangat efisien dengan teknik yang dapat diskalakan. Di sini, elektroda Raney-Ni modulasi Fe (NFA-CA) baru dikembangkan melalui penyemprotan plasma atmosferik dan teknik etsa kimia. Elektroda yang dihasilkan menunjukkan aktivitas katalitik bifungsional tinggi dengan overpotensial rendah dan kemiringan Tafel (HER: 27 mV pada 10 mA cm −2 , 20 mV dec −1 ; OER: 169 mV pada 10 mA cm −2 , 49 mV dec −1 ), bersaing untuk katalis logam mulia dan senyawa berbasis logam transisi terkemuka yang dilaporkan dalam literatur. Selain itu, elektroliser AEM yang sesuai hanya membutuhkan 1,56 V untuk menggerakkan 1 A cm −2 dan daya tahan luar biasa selama 1000 jam. Selain itu, sel AEM dapat mencapai 2 A cm −2 pada 1,79 V, melampaui target Departemen Energi Amerika Serikat untuk sistem AWE (2 A cm −2 pada 1,80 V). Kinerja yang sangat efisien dan tahan lama ini dikaitkan dengan struktur nanokristal NiFe (inti)-NiFe hidroksida (kulit) yang dibuat melalui perlakuan tersebut. Struktur ini tidak hanya memfasilitasi sifat elektrokatalitik yang unggul tetapi juga dipertahankan setelah 1000 jam operasi berkelanjutan. Dianggap bahwa pendekatan saat ini dapat menawarkan rute yang menarik untuk fabrikasi elektroda berbasis NiFe yang dapat diskalakan untuk elektroliser air AEM industri.
1 Pendahuluan
Hidrogen, dengan kepadatan energinya yang tinggi (142 kJ g −1 ), dianggap sebagai pembawa energi yang menarik untuk digabungkan dengan daya terbarukan untuk menggantikan sebagian bahan bakar fosil guna mengatasi masalah penipisan energi dan polusi lingkungan. [ 1 – 3 ] Saat ini, elektrolisis air dianggap sebagai salah satu teknologi yang menjanjikan untuk produksi hidrogen yang bersih, sangat murni, dan efisien. [ 4 , 5 ] Teknologi elektroliser air suhu rendah terdiri dari elektrolisis air alkali (AWE), elektrolisis air membran pertukaran proton (PEMWE), dan elektrolisis air membran pertukaran anion (AEMWE). Di antara semuanya, AWE, sebagai teknologi yang paling matang, memungkinkan penerapan logam golongan nonmulia (non-PGM) yang hemat biaya dan melimpah di bumi sebagai komponen elektroliser berdasarkan lingkungan operasi alkali. [ 6 ] Namun, struktur diafragma berpori konvensional tidak hanya mengalami kekurangan kemampuan untuk menghasilkan gas dengan kemurnian tinggi tetapi juga menyebabkan efisiensi operasi yang buruk. [ 7 ] Meskipun PEMWE menghasilkan produksi hidrogen yang sangat cepat dan sangat murni, hal ini diuntungkan oleh desain sistem yang ringkas dengan membran pertukaran proton sebagai pemisah. [ 8 , 9 ] Sistem ini beroperasi dalam lingkungan asam dan harus menggunakan elektroda/katalis PGM dan pelat bipolar titanium untuk menjamin efisiensi elektroliser PEM yang sangat baik, sehingga menghasilkan biaya produksi yang tinggi dan stabilitas yang lemah. [ 10 , 11 ] Dengan demikian, AEMWE dengan integrasi keunggulan AWE dan PEMWE, secara luas diyakini sebagai teknologi yang menjanjikan untuk aplikasi komersial dalam skala besar. AEMWE lebih menyukai produksi gas yang efisien dan sangat murni daripada PEMWE, lebih jauh lagi, hal ini memungkinkan lingkungan antarmuka basa karena membran menghantarkan anion alih-alih kation, sehingga bahan non-PGM dapat digunakan sebagai komponen sistem AEMWE. [ 2 , 12 , 13 ]
Namun demikian, untuk komersialisasi AEMWE, masih ada kendala di bagian pengembangan komponen sel, yang menuntut katalis/elektroda yang berlimpah di bumi, sangat aktif, dan kuat untuk membawa AEMWE ke kerapatan arus skala industri untuk operasi jangka panjang. Dalam lingkungan alkali, tantangan utama untuk efisiensi elektrolisis berasal dari hambatan kinetik dan termodinamika yang lamban dari dua setengah reaksi: reaksi evolusi hidrogen (HER) di katode dan reaksi evolusi oksigen (OER) di anoda. [ 14 , 15 ] Saat ini, katalis komersial yang paling aktif untuk reaksi evolusi oksigen (OER) dan reaksi evolusi hidrogen (HER) adalah oksida logam mulia seperti IrO 2 /RuO 2 dan senyawa berbasis Pt. [ 16 – 18 ] Namun, biaya tinggi, kelangkaan, dan daya tahan terbatas dari katalis PGM ini secara signifikan membatasi penggunaan praktisnya dalam aplikasi industri. Oleh karena itu, pengembangan bahan katalitik logam yang melimpah dan hemat biaya sangat penting untuk memungkinkan penerapan teknologi elektrolisis air berskala besar yang luas dan efisien. [ 19 – 21 ]
Ni/Fe/Co/Mn (oksi)hidroksida adalah salah satu katalis yang paling disukai dalam pemisahan air alkali, karena aktivitas intrinsik OER yang menonjol dan aktivitas HER yang wajar, yang telah merangsang minat yang luas dari para peneliti untuk mengeksplorasi potensi mereka untuk elektrolisis air industri. [ 22 – 25 ] Namun, Ni/Fe/Co/Mn (oksi)hidroksida masih menghadapi beberapa tantangan serius, termasuk konduktivitas yang tidak memadai, situs aktif yang terbatas, dan stabilitas yang lemah. [ 26 , 27 ] Kekurangan ini menghambat penerapannya dalam AEMWE untuk layanan jangka panjang di bawah kerapatan arus skala industri (≥1 A cm −2 ). Mengingat tantangan ini, penelitian kami mengeksplorasi pendekatan yang dapat diskalakan untuk merekayasa jenis baru katalis NiFe: Raney-Ni pemodulasi Fe. Katalis Raney Ni terkenal karena luas permukaannya yang tinggi dan kinerja katalitik yang sangat baik, terutama untuk HER. [ 28 , 29 ] Dengan mendoping Fe ke dalam Raney Ni, nanokristalin hidroksida NiFe yang berasal dari nanokristal induk paduan NiFe yang didukung oleh kerangka paduan NiAl yang stabil menghasilkan konduktivitas dan stabilitas listrik yang jauh lebih baik, serta struktur berpori yang sangat besar seperti katalis Raney Ni yang menyediakan area permukaan aktif yang lebih besar. Akibatnya, katalis NiFe yang dikembangkan secara efektif meningkatkan keterbatasan alami (konduktivitas yang tidak memadai) hidroksida NiFe dan secara signifikan meningkatkan efisiensi katalitik dan stabilitas jangka panjang.
Penggunaan proses yang dapat diskalakan dan berbiaya rendah untuk fabrikasi elektroda juga penting untuk pengembangan dan penerapan AEMWE. Sebagian besar proses yang umum digunakan untuk persiapan NiFe hidroksida, seperti hidrotermal dan elektrodeposisi, tidak cukup sebagai protokol sintesis skala besar yang sederhana. Teknik penyemprotan plasma atmosfer (APS) merupakan pilihan ideal untuk fabrikasi katalis/elektroda yang menargetkan elektroliser air industri skala besar, yang menawarkan keuntungan signifikan berupa skalabilitas, efektivitas biaya, fleksibilitas, dan kelayakan ukuran besar. [ 30 – 32 ]
Di sini, prekursor katalis Raney-Ni yang didoping Fe disiapkan melalui teknologi APS. Setelah aktivasi kimia berikutnya, nanokristalin hidroksida NiFe yang mengelilingi nanokristalin paduan NiFe dihasilkan sambil didukung oleh kerangka paduan NiAl yang stabil. Katalis yang dihasilkan (disebut sebagai NFA-CA) menunjukkan efisiensi katalitik yang sangat baik yang berasal dari spesies yang sangat aktif dari nanokristalin NiFe yang kaya akan cacat. Secara paralel, nanokristalin paduan NiFe menawarkan matriks yang sangat konduktif yang mendorong transpor elektron yang efisien, yang berkontribusi pada reaksi katalitik efisiensi tinggi yang berkelanjutan dari nanokristalin hidroksida NiFe. Hasil XANES dan FT-EXAFS menunjukkan bahwa Fe berhasil didoping ke dalam Raney-Ni, yang ada dalam bentuk struktur inti-kulit nanokristalin NiFe–nanokristalin hidroksida NiFe. Kami menunjukkan bahwa struktur ini tidak hanya mempromosikan transfer muatan tetapi juga sejumlah besar situs aktif Ni dalam nanokristalin NiFe hidroksida terbentuk karena koordinasi tak jenuh yang diperluas, sehingga meningkatkan aktivitas elektrokatalitik total elektroda NFA-CA. Selain itu, kerangka paduan NiAl memberikan dukungan mekanis yang kuat dan ketahanan korosi yang memadai, memastikan daya tahan elektroda yang sangat baik dalam lingkungan alkali. [ 31 , 33 ] Untuk memamerkan kinerja sel yang luar biasa, kami telah membangun elektroliser AEM 5 cm 2 dengan elektroda NFA-CA yang memerlukan 1,75 V untuk menggerakkan 1 A cm −2 dalam 1 M KOH pada 25 °C, dan hanya 1,56 V untuk mencapai 1 A cm −2 dalam elektrolit 1 M KOH pada 60 °C, mengungguli sebagian besar katalis yang dilaporkan. Menariknya, sel kami mencapai ketahanan yang memadai selama 1000 jam tanpa degradasi pada 1 A cm −2 , yang didukung oleh interkoneksi yang baik antara nanokristal NiFe (inti)-nanostruktur nanokristalin hidroksida NiFe (cangkang) dengan kerangka paduan NiAl. Hasil ini menggambarkan metode yang efisien dan dapat diskalakan untuk mengembangkan elektroda berbiaya rendah tetapi sangat fungsional yang dapat meningkatkan viabilitas sistem elektrolisis air AEM generasi berikutnya.
2 Hasil dan Pembahasan
2.1 Karakterisasi Fisikokimia Elektroda NFA-CA
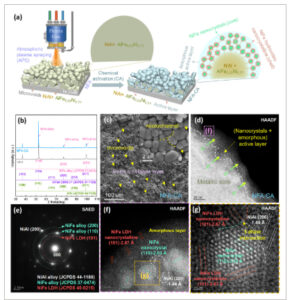
Bubuk paduan Ni-Fe-Al buatan rumah, digunakan sebagai prekursor katalis untuk elektroda NFA-CA, diproduksi melalui proses penyemprotan atomisasi di bawah atmosfer argon. Morfologi bubuk ini ditampilkan dalam Gambar S1a–c (Informasi Pendukung). Analisis XRD (Gambar S1d , Informasi Pendukung) mengonfirmasi bahwa bubuk tersebut terdiri dari fase AlNi 0,77 Fe 0,23 dan NiAl. Gambar 1a menyajikan ilustrasi skema pengembangan elektroda NFA-CA. Elektroda NFA-CA, yang berasal dari bubuk paduan Ni-Fe-Al, disintesis melalui metode dua langkah. Proses ini melibatkan penyemprotan plasma atmosfer (APS), diikuti oleh etsa kimia, seperti yang dijelaskan lebih rinci dalam Informasi Pendukung. Proses dua langkah umumnya digunakan untuk menyiapkan elektroda berbasis pelapis Raney-Ni, seperti yang dijelaskan dalam pekerjaan kami sebelumnya. [ 31 , 33 ] Secara khusus, serbuk Ni-Fe-Al diendapkan pada pelat nikel berlubang (NP) menggunakan APS. Pelat nikel yang dilapisi serbuk Ni-Fe-Al disebut sebagai NFA. Mikrostruktur berpori yang jelas dengan rongga mikro yang diperkenalkan oleh APS diamati, seperti yang ditunjukkan pada Gambar S2a,d (Informasi Pendukung). Selanjutnya, proses aktivasi kimia (CA) yang melibatkan etsa kimia digunakan untuk mengaktifkan NFA, menghasilkan elektroda akhir, yang disebut sebagai NFA-CA. Khususnya, lapisan paduan AlNi 0,77 Fe 0,23 dalam NFA mengalami pelindian elemen Al parsial dengan perendaman dalam larutan alkali (6 M KOH) pada 80 °C selama 24 jam, yang mengarah pada pembentukan banyak pori, termasuk pori-pori besar dan halus, seperti yang ditunjukkan pada Gambar S2b,c,e,f (Informasi Pendukung). Seperti yang diantisipasi, proses ini menghasilkan pembentukan lapisan amorf yang kaya akan cacat yang tertanam dengan sejumlah nanokristal NiFe (inti)-struktur nanokristalin hidroksida NiFe (kulit). Struktur nano inti-kulit ini saling terhubung oleh kerangka NiAl. Elektroda NFA-CA yang dihasilkan akan berfungsi sebagai elektrokatalis bifungsional untuk HER dan OER dalam elektrolisis air alkali.
Gambar 1
Buka di penampil gambar
Presentasi PowerPoint
Ilustrasi skema dan karakterisasi fisik katalis NFA-CA. a) Ilustrasi skema preparasi elektroda NFA-CA; b) Pola XRD dari NFA dan NFA-CA; c) Gambar khas katalis NFA-CA dari SEM; d) Gambar HAADF-TEM; e) Pola SAED lapisan katalis NFA-CA; f) Gambar HR-STEM dari nanokristal NiFe, NiFe hidroksida nanokristalin, dan amorf dalam lapisan katalitik NFA-CA; g) Gambar atom dari persimpangan 3 fase (nanokristal NiFe, NiFe hidroksida nanokristalin, dan paduan NiAl) dalam lapisan katalitik NFA-CA.
Spektrum XRD digunakan untuk mempelajari fase-fase sampel NFA-CA. Sampel NFA digunakan sebagai sampel referensi untuk menyajikan evolusi struktur pada proses CA. Seperti yang ditunjukkan pada Gambar 1b , pola XRD menunjukkan bahwa NFA terdiri dari AlNi 0,77 Fe 0,23 (JCPDS No. 47–1126) dan NiAl (JCPDS No. 44–1188), sementara puncak-puncak pada sampel NFA-CA berhubungan dengan NiAl (JCPDS No. 44–1188) dan paduan NiFe (JCPDS No. 37–0474). Khususnya, paduan NiFe yang diperoleh ditransfer dari prekursor AlNi 0,77 Fe 0,23 dengan sejumlah besar spesies Al yang terlindi pada proses CA. Perlu disebutkan bahwa paduan NiAl biasanya bertindak sebagai rangka elektroda berbasis nikel-Raney yang spesifik, karena sifatnya yang stabil dalam lingkungan rendaman. [ 31 , 33 ]
NFA-CA mengungkapkan morfologi khas rongga mikro dan mikrokanal yang kasar dan berpori di seluruh permukaan, yang disebabkan oleh penyemprotan termal dan proses CA, seperti yang ditunjukkan pada gambar SEM pada Gambar 1c . Ini akan memperluas luas permukaan elektrokimia dan meningkatkan lokasi nukleasi gelembung. [ 31 , 33 ] Untuk menyelidiki lebih lanjut lapisan katalitik aktif dari mikropartikel yang dilapisi elektroda NFA-CA, TEM pemindaian (STEM) dilakukan untuk menganalisis irisan tipis penampang melintang yang dipotong dari mikropartikel NFA-CA melalui teknologi Focused Ion Beam (FIB). Gambar STEM High-Angle Annular Dark-Field (HAADF) pada Gambar 1d menunjukkan kontras yang jelas antara bagian tengah dan tepi mikropartikel dari NFA-CA, yang menunjukkan munculnya inti logam dan struktur hibrida nanokristal/cangkang amorf yang didoping non-logam. Struktur spesifik ini akan memastikan pengangkutan elektron yang sangat baik dari inti ke cangkang yang terdiri dari situs aktif katalitik, sehingga meningkatkan aktivitas OER/HER katalitik elektroda NFA-CA. Pembentukan cangkang hibrida spesifik ini terkait dengan proses CA spesifik, yang melibatkan etsa kimia spesies Al dari prekursor AlNi 0,77 Fe 0,23 dan strategi rekonstruksi melalui pertukaran ion spontan dengan sejumlah besar ion hidroksida/sejumlah kecil molekul oksigen (dari elektrolit mandi) yang menempati kekosongan yang tersisa setelah pelindian Al. Ion hidroksida dan molekul oksigen ini secara otomatis akan bereaksi dengan struktur kisi NiFe yang tidak stabil, akhirnya membentuk cangkang stabil yang terdiri dari nanokristal hibrida dan fase amorf, seperti yang diharapkan. Gambar S3 (Informasi Pendukung) memberikan bukti untuk mendukung proses evolusi struktur ini. Cangkang stabil yang menutupi permukaan elektroda NFA-CA ini akan melindungi inti logam internal dari korosi elektrolit, sehingga membentuk struktur inti-cangkang yang sangat stabil. Selain itu, cincin difraksi elektron area terpilih (SAED) pada Gambar 1e menunjukkan pembentukan nanokristal paduan NiFe (JCPDS No. 37–0474) dengan bidang kisi (110), dan (200), pembentukan hidroksida NiFe nanokristalin/amorf (JCPDS No. 440-0215) dengan fitur difraksi cincin/halo hibrida, serta munculnya paduan kerangka NiAl (JCPDS No. 44–1188) dengan bidang kisi (200), yang konsisten dengan analisis XRD. Gambar 1fmengungkapkan bahwa lapisan aktif elektroda NFA-CA terdiri dari nanokristal NiFe yang kaya cacat dengan lapisan amorf dengan ketebalan sekitar 3 nm. Selain itu, nanokristal NiFe hidroksida dengan bidang kisi (101) ditemukan pada permukaan lapisan amorf. Untuk menyelidiki lebih lanjut nanostruktur unik tersebut, gambar kisi dengan perpotongan 3 fase diamati pada Gambar 1g . Struktur inti-kulit nanokristal NiFe-hidroksida nanokristal NiFe yang spesifik akan meningkatkan konduktivitas NiFe hidroksida karena adanya nanokristal NiFe metalik. [ 34 , 35 ] Selain itu, bidang kisi (200) pada perpotongan 3 fase semakin menegaskan keberadaan NiAl. Fitur-fitur struktural yang khas ini diharapkan dapat meningkatkan kinetika katalitik HER dan OER.
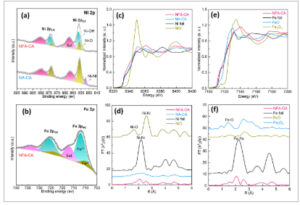
Spektroskopi fotoelektron sinar-X (XPS) dilakukan untuk menyelidiki komposisi kimia dan struktur elektronik dari lapisan katalitik dalam elektroda NFA-CA. Elektroda NA-CA (nikel Raney tradisional tanpa doping Fe), seperti yang dilaporkan dalam pekerjaan sebelumnya, [ 31 – 33 ] digunakan sebagai sampel kontrol. Dalam spektrum Ni 2p dari sampel NFA-CA, puncak yang dipasang dari Ni 2p3/2 dan 2p1/2 pada 855,8 eV dan 873,2 eV menunjukkan Ni-O, sedangkan puncak pada 862,2 eV dan 880,3 eV mewakili puncak satelit (diberi label sebagai “sat.”); puncak pada 857,5 eV dan 875,1 eV sesuai dengan Ni─OH, seperti yang diilustrasikan dalam Gambar 2a . Dalam spektrum Ni 2p untuk sampel NA-CA (Raney-Ni), Ni─O yang dominan teramati, tanpa deteksi Ni─OH, sementara puncak minor pada 852,1 eV dalam spektrum Ni 2p 3/2 dikaitkan dengan Ni─Ni metalik. Perlu dicatat, hasil ini menunjukkan bahwa keadaan elektronik Ni dalam NFA-CA diatur oleh modulasi Fe dan cenderung bergeser ke arah keadaan valensi tinggi, dibandingkan dengan sampel NA-CA, yang terutama dikaitkan dengan efek doping Fe. [ 36 ] Energi pengikatan pada 712,3 eV dan 725,7 eV dikaitkan dengan puncak Fe 2p3/2 dan Fe 2p1/2, masing-masing, yang merupakan karakteristik Fe 3+ , seperti yang ditunjukkan pada Gambar 2b . [ 37 , 38 ] Selain itu, ada sinyal Fe 2+ . Spektrum O 1s (Gambar S4 , Informasi Pendukung) menyajikan tiga puncak yang didekonvolusi pada 529,9, 531,6, dan 533,5 eV, yang masing-masing berkorespondensi dengan ikatan logam-oksigen (M─O), oksigen dalam gugus hidroksida (M-OH), dan molekul air yang diserap secara kimia (O 2ads ). [ 39 – 41 ] Khususnya, tidak ada keadaan logam Ni dan Fe yang dihapus, terutama karena nanokristal NiFe ditutupi oleh nanokristalin hidroksida NiFe dan lapisan amorf (Gambar 1f ). Temuan ini menunjukkan bahwa integrasi Fe dan keberadaan nanokristalin hidroksida NiFe antarmuka dapat menyesuaikan konfigurasi elektronik situs Ni dalam NFA-CA, sehingga mengoptimalkan adsorpsi perantara HER/OER pada katalis NFA-CA. [ 42 ]
Gambar 2
Buka di penampil gambar
Presentasi PowerPoint
Keadaan kimia dan koordinasi atom katalis NFA-CA. Spektrum XPS resolusi tinggi untuk Ni 2p a) dan Fe 2p b); c) Spektrum tepi-K XANES Ni dan d) Kurva FT NFA-CA, NA-CA, NiO, dan foil Ni; e) Spektrum tepi-K XANES Fe dan (f) Kurva FT NFA-CA, Fe 2 O 3 , FeO, dan foil Fe.
Pengukuran spektroskopi serapan sinar-X (XAS) dilakukan untuk mendapatkan penyelidikan lebih dalam tentang struktur elektronik dan lokal NFA-CA. Gambar 2c,d menyajikan spektrum struktur tepi-dekat serapan sinar-X tepi-K Ni (XANES, Gambar 2c ) dan spektrum struktur halus serapan sinar-X yang diperluas dengan transformasi Fourier (FT-EXAFS, Gambar 2d ) dari NFA-CA, NA-CA (Raney-Ni), NiO, dan foil Ni. Puncak utama NFA-CA sangat mirip dengan sampel foil Ni, yang menyiratkan bahwa keadaan kimia utama Ni dalam NFA-CA adalah Ni (0), yang dikaitkan dengan keberadaan sejumlah besar nanokristal paduan NiFe. Dalam spektrum EXAFS berbobot k2 yang ditransformasikan Fourier pada tepi K Ni (Gambar 2d ), NFA-CA menunjukkan satu puncak menonjol yang sesuai dengan cangkang Ni–Ni pada sekitar 2,10 Å, yang sebanding dengan referensi foil Ni (≈2,18 Å). Sebaliknya, referensi NiO menunjukkan dua puncak karakteristik untuk ikatan Ni─O dan Ni─Ni masing-masing pada 1,6 dan 2,6 Å. Intensitas puncak yang berkurang untuk ikatan Ni─Ni pada NFA-CA relatif terhadap foil Ni menunjukkan defisiensi koordinasi di sekitar Ni. Secara khusus, fitting EXAFS tepi K Ni mengungkapkan bahwa NFA-CA memiliki nomor koordinasi (CN) yang lebih rendah (Ni–Ni≈5,7 dan Ni–Fe ≈ 3,9) dibandingkan dengan foil Ni (≈12) (lihat Tabel S1 , Informasi Pendukung). CN yang lebih rendah ini kemungkinan disebabkan oleh jumlah atom permukaan yang lebih tinggi yang terekspos dalam nanokristal hidroksida NiFe yang kaya cacat, di mana koordinasi tak jenuh yang mengembang diantisipasi untuk mengaktifkan lebih banyak situs Ni untuk katalisis. [ 43 ] Menariknya, CN dari kulit Ni─O di NFA-CA adalah 3,4, yang lebih kecil daripada kulit yang sesuai dari NA-CA (Raney-Ni, 3,6) dan N─O komersial (5,8), menunjukkan lingkungan koordinasi Ni yang lebih tak jenuh di NFA-CA.
Gambar 2e menunjukkan spektrum XANES Fe K-edge dari NFA-CA, di samping spektrum referensi untuk foil Fe, FeO, dan Fe 2 O 3 . Tepi adsorpsi NFA-CA terletak di dekat foil Fe, yang menunjukkan bahwa keadaan kimia dominan Fe dalam NFA-CA adalah Fe (0), yang juga dikaitkan dengan kehadiran signifikan nanokristal paduan NiFe. Gambar 2f menunjukkan transformasi Fourier dari spektrum FT-EXAFS Fe K-edge untuk NFA-CA, foil Fe, FeO, dan Fe 2 O 3 . Sampel NFA-CA menampilkan puncak yang kuat pada sekitar 2,07 Å, dekat dengan referensi foil Ni (≈2,22 Å). Mirip dengan Ni, intensitas puncak yang berkurang relatif terhadap ikatan Fe─Fe dalam foil Fe menunjukkan defisiensi koordinasi di sekitar Fe. Fitting Fe K-edge EXAFS mengonfirmasi bahwa NFA-CA memiliki CN yang lebih rendah (Fe–Fe ≈ 2,1 dan Fe–Ni ≈ 6,8) dibandingkan dengan foil Fe (≈12) (lihat Tabel S2 , Informasi Pendukung). CN cangkang Fe-O dalam NFA-CA adalah 1,1, jauh lebih rendah daripada nilai untuk cangkang yang sesuai dalam FeO dan Fe₂O₃ komersial, yang masing-masing adalah 5,9 dan 5,7. Ini menunjukkan bahwa Fe dalam NFA-CA hanya mengalami oksidasi ringan. Perlu dicatat bahwa hasil ini tidak sepenuhnya konsisten dengan data XPS, yang mungkin disebabkan oleh kedalaman penyelidikan yang berbeda dari kedua teknik tersebut. Misalnya, XPS biasanya hanya menganalisis 3–6 nanometer teratas dari permukaan, sedangkan XAS dapat menyelidiki kedalaman yang mencapai puluhan nanometer. Namun, hasil ini selaras dengan nanostruktur spesifik NFA-CA, di mana lapisan NiFe LDH amorf setebal ≈5 nm menutupi permukaan, seperti yang diilustrasikan dalam gambar HR-STEM pada Gambar 1f . Lapisan NiFe LDH amorf ini secara signifikan membatasi XPS dari mendeteksi nanokristal paduan NiFe yang lebih dalam. Sebagai kesimpulan, temuan ini menunjukkan bahwa Fe berhasil didoping ke Raney-Ni, dan ada dalam bentuk struktur inti-kulit nanokristal NiFe–nanokristalin hidroksida NiFe, yang tidak hanya mempromosikan transpor elektron superior dari nanokristal NiFe ke nanokristalin hidroksida NiFe, tetapi juga memperoleh lebih banyak situs Ni aktif dari nanokristalin NiFe hidroksida untuk katalisis karena koordinasi tak jenuh yang diperluas, sehingga meningkatkan aktivitas katalitik total elektroda NFA-CA.
2.2 Karakterisasi Elektrokimia untuk HER dan OER
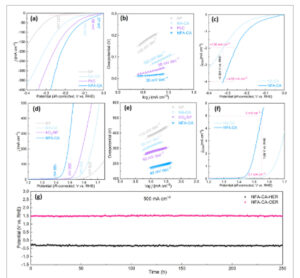
Aktivitas elektrokatalitik untuk HER dievaluasi dengan menerapkan sistem uji tiga elektroda spesifik dalam elektrolit KOH 1 M. Seperti yang ditunjukkan dalam kurva polarisasi LSV pada Gambar 3a , elektroda NFA-CA menghasilkan overpotensial hanya 27 dan 165 mV pada rapat arus 10 dan 100 mA cm −2 , yang jauh lebih rendah daripada elektroda Pt/C dengan 58 dan 196 mV, serta elektroda NA-CA (104 dan 248 mV) dan NP (231 dan 352 mV). Overpotensial sangat rendah yang diperoleh sebanding dengan katalis HER/OER terkini yang dilaporkan. [ 44 – 47 ] Dalam hal ini, pengenalan Fe dalam katalis Raney Ni dapat sangat meningkatkan aktivitas HER, yang diuntungkan oleh struktur elektronik yang dioptimalkan. Selain itu, kemiringan Tafel diselidiki untuk menentukan kinetika reaksi katalis, seperti yang ditunjukkan pada Gambar 3b . Kemiringan Tafel terendah sebesar 20 mV dec −1 ditampilkan dalam elektroda NFA-CA, dibandingkan dengan Pt/C (58 mV dec −1 ), NA-CA (102 mV dec −1 ), dan NP (148 mV dec −1 ), yang membuktikan transpor elektron yang lebih cepat dan kinetika reaksi yang menguntungkan. Perlu dicatat bahwa kemiringan Tafel yang disajikan di sini adalah nilai nyata, yang diperoleh dalam kondisi arus rendah di mana kontrol kinetik diasumsikan. Namun, perbedaan potensial dalam ECSA dan dinamika gelembung gas dapat memengaruhi nilai kemiringan yang tepat. Dengan demikian, kemiringan tersebut terutama digunakan di sini untuk membandingkan tren relatif di seluruh sampel daripada untuk analisis mekanistik yang ketat. Untuk menilai luas permukaan aktif elektrokimia (ECSA) dari katalis berbasis Ni, metode spektroskopi impedansi elektrokimia (EIS) digunakan. Karena katalis hidroksida berbasis Ni, daerah potensial nonfaradaik sebelum puncak oksidasi Ni(II) bersifat nonkonduktif, yang menghambat pengukuran elektrokimia yang akurat. [ 48 ] Kapasitansi yang teradsorpsi (C a ) dihitung dari EIS, seperti yang ditunjukkan pada Gambar S5 (Informasi Pendukung). Dengan C a yang diperoleh , ECSA dari NFA-CA dan NA-CA masing-masing adalah 142 cm 2 dan 110 cm 2 , yang digunakan untuk menormalkan kerapatan arus untuk mengungkap aktivitas katalitik intrinsik dari katalis yang disiapkan (Gambar 3c ). Pada j ECSA (kerapatan arus dinormalisasi ke ECSA) sebesar −4,00 mA cm −2 , overpotensial yang digerakkan adalah 0,324 V versus RHE untuk NFA-CA, sementara NA-CA hanya mencapai j ECSA sebesar −1,96 mA cm −2pada potensi ini. Hal ini selanjutnya memperkuat bahwa struktur elektronik yang diatur dari situs aktif untuk NFA-CA dengan doping Fe mengurangi penghalang energi reaksi yang melekat pada HER. Perlu dicatat bahwa meskipun aktivitas intrinsik NFA-CA secara signifikan lebih rendah daripada Pt/C, seperti yang ditunjukkan pada Gambar S6a–c (Informasi Pendukung), NFA-CA menunjukkan aktivitas HER keseluruhan yang lebih tinggi. Hal ini dapat dikaitkan dengan luas permukaan elektrokimia yang jauh lebih besar (ECSA, 142 cm 2 ) dan perilaku pelepasan gelembung gas yang berpotensi lebih baik. Selain itu, aktivitas HER dari NFA-CA dibandingkan dengan katalis HER terkemuka yang didokumentasikan dalam Tabel S3 (Informasi Pendukung), melebihi sebagian besar katalis yang dilaporkan.
Gambar 3
Buka di penampil gambar
Presentasi PowerPoint
Kinerja HER/OER untuk katalis NFA-CA. a) Kurva LSV untuk HER; b) Plot Tafel yang sesuai untuk HER; c) Kurva LSV berdasarkan kerapatan arus ECSA yang dinormalkan untuk HER; d) Kurva LSV untuk OER; e) Plot Tafel yang sesuai untuk OER; f) Kurva LSV berdasarkan kerapatan arus ECSA yang dinormalkan untuk HER; g) Uji stabilitas jangka panjang NFA-CA selama 250 jam untuk OER dan HER di bawah 500 mA cm −2 .
Kinerja OER dari elektroda juga dievaluasi dalam kondisi yang identik, seperti yang ditunjukkan pada Gambar 3d yang memperlihatkan aktivitas katalitik OER yang tinggi dari NFA-CA, mencapai kerapatan arus sebesar 10 dan 100 mA cm −2 pada potensial berlebih sebesar 169 dan 236 mV, yang tidak hanya jauh lebih rendah daripada NA-CA (310 dan 394 mV) dan NP (375 dan 500 mV) tetapi juga katalis logam mulia komersial IrO 2 /NF sebesar 268 dan 329 mV. Selain itu, kemiringan Tafel yang lebih rendah dari NFA-CA dengan 49 mV dec −1 mengungkapkan kinetika reaksi yang lebih cepat menuju OER, dibandingkan dengan elektroda lain NA-CA (88 mV dec −1 ), NP (114 mV dec −1 ) dan IrO 2 /NF (63 mV dec −1 ), seperti yang ditunjukkan pada Gambar 3e . Aktivitas katalitik intrinsik tertinggi setelah normalisasi ECSA masih diperoleh di NFA-CA, mendorong j ECSA sebesar 5 mA cm −2 pada potensial 1,55 V versus RHE, sedangkan NA-CA hanya mencapai j ECSA sebesar 0,1 mA cm −2 , seperti yang ditunjukkan pada Gambar 3f . Aktivitas OER dari NFA-CA dibandingkan dengan katalis OER terkemuka yang dilaporkan, seperti yang ditunjukkan pada Tabel S4 (Informasi Pendukung). Aktivitas OER yang diperoleh melebihi sebagian besar katalis yang dilaporkan. Selain itu, hampir tidak ada degradasi aktivitas katalitik untuk NFA-CA setelah HER/OER jangka panjang selama 250 jam pada 500 mA cm −2 , membuktikan stabilitas katalitiknya yang sangat baik terhadap HER/OER (4(g)).
Dalam hal peningkatan kinerja HER/OER untuk katalis NFA-CA, spesies hidroksida NiFe yang tumbuh pada paduan NiFe dapat dimanfaatkan. Untuk katalis Raney Ni yang didoping Fe yang inovatif ini, keberadaan kerangka paduan NiAl dapat berkontribusi pada stabilitas struktural dan kinerja yang sangat baik, seperti yang dilaporkan sebelumnya. [ 31 , 33 ] Sementara itu, struktur paduan NiFe-hidroksida-NiFe yang spesifik, bersama dengan kerangka NiAl yang stabil, dapat mengurangi risiko delaminasi dan degradasi dalam kondisi operasional. Akibatnya, elektroda NFA-CA memiliki potensi untuk dievaluasi dalam sel elektroliser AEM yang beroperasi pada kerapatan arus yang relevan secara industri.
2.3 Validasi Elektroda yang Dikembangkan untuk Elektrolisis Air AEM
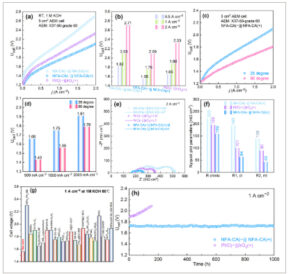
Untuk memberikan contoh penerapan praktis elektroda NFA-CA yang dikembangkan, kami membangun sistem elektroliser AEM dengan luas permukaan 5 cm2 dengan merakit NFA-CA pada kedua sisi membran pertukaran anion (Sustainion X37-50) untuk bertindak sebagai katode dan anoda (disebut sebagai NFA-CA(‒)||NFA-CA(+), berturut-turut). Elektrolitnya adalah 1 M KOH, dan pengujian dilakukan pada suhu ruangan (T = 25 °C) dan suhu tinggi (T = 60 °C). Konfigurasi elektroliser AEM yang sesuai dari NA-CA(‒)||NA-CA(+) dan Pt/C(‒)||IrO2 ( +) digunakan sebagai tolok ukur untuk menyelidiki efek doping Fe pada katalis berbasis Raney Ni. Menariknya, kurva potensial arus pada Gambar 4a,b menunjukkan peningkatan kinerja sel saat dilengkapi dengan NFA-CA(‒)||NFA-CA(+) pada RT. Secara khusus, sel NF-CA(‒)||NFA-CA(+) hanya memerlukan 1,74 dan 2,07 V untuk mencapai kerapatan arus masing-masing 1,0 dan 2,0 A cm −2 , sementara sel NA-CA(‒)||NA-CA(+) mencatat tegangan 2,10 dan 2,67 V. Sel elektroda yang dimodifikasi memiliki kinerja yang lebih baik daripada sel Pt/C(‒)||IrO 2 (+), yang memerlukan 1,88 dan 2,33 V untuk kerapatan arus yang sama. Mengingat standar operasi elektroliser alkali industri saat ini (50–90 °C), kami selanjutnya menganalisis kinerja sel NFA-CA(‒)||NFA-CA(+) pada 60 °C. Seperti yang ditunjukkan pada Gambar 4c,d , elektroliser AEM mencapai tegangan sel yang lebih rendah sebesar 1,56, 1,79 V pada 1,0, 2,0 A cm −2 , sedangkan sel NA-CA(‒)||NA-CA(+) memerlukan tegangan sel sebesar 1,91 V untuk mencapai 1,0 A cm −2 , seperti yang ditunjukkan pada Gambar S7a (Informasi Pendukung). Pengukuran EIS pada 0,1 A cm⁻ 2 dilakukan untuk menyelidiki penurunan kinerja sel yang diamati, seperti yang ditunjukkan pada Gambar S7b,c (Informasi Pendukung). Hasilnya menunjukkan peningkatan substansial dalam resistansi ohmik, yang mencerminkan konduktivitas ionik yang lebih rendah dari elektrolit KOH yang diencerkan. Selain itu, sedikit peningkatan dalam resistansi perpindahan muatan diamati, menyiratkan bahwa konsentrasi OH⁻ yang berkurang dapat membatasi kinetika reaksi elektrokimia.
Gambar 4
Buka di penampil gambar
Presentasi PowerPoint
Kinerja AEMWE. a) Kurva polarisasi untuk AEMWE dengan berbagai elektroda pada 25 °C; b) Perbandingan tegangan sel pada kerapatan arus yang berbeda; c) Kurva polarisasi untuk sel NFA-CA(−)||NFA-CA(+) pada 25 °C dan 60 °C; d) Perbandingan tegangan sel NFA-CA(−)||NFA-CA(+) pada 25 °C dan 60 °C; e) Plot Nyquist dari pengukuran EIS untuk sel AEM dengan berbagai elektroda; f) Data yang disesuaikan dari plot Nyquist; g) Perbandingan kinerja sel AEM dengan pekerjaan yang dilaporkan; [ 51 – 72 ] h) Stabilitas operasi jangka panjang pada 1 A cm −2 untuk NFA-CA(−)||NFA-CA(+) AEMWE.
EIS in situ juga dilakukan untuk menganalisis kinerja elektroda yang dikembangkan dalam sel AEMWE di bawah 2 A cm −2 . Sisipan Gambar 4e menyajikan model rangkaian ekuivalen yang paling sesuai, termasuk dua pasangan elemen fase konstan resistor (CPE 1 dan CPE 2 ) secara paralel dengan dua resistor tambahan (R 1,ct, dan R 2,mt ), secara seri dengan elemen induktor (L) dan resistor ohmik (R ohmik ). CPE 1 dan CPE 2 dikaitkan dengan kapasitansi lapisan ganda yang dikaitkan dengan dua lengkung busur dari frekuensi tinggi ke frekuensi rendah dalam plot Nyquist Gambar 4e , masing-masing. R 1, ct menggambarkan resistansi perpindahan muatan karena kinetika HER dan OER, sementara R 2, mt menunjukkan resistansi perpindahan massa yang melibatkan pengangkutan gas/cairan dan R 2, mt menunjukkan resistansi perpindahan massa yang terkait dengan perpindahan gas/cairan. Resistansi R ohmik yang terletak pada perpotongan sumbu-x di sisi kiri grafik Nyquist mencakup semua resistansi internal, dari membran, elektroda, pelat bipolar (BPP), dan resistansi kontak. Induktor (L) yang dihubungkan secara seri dengan resistor (R) menandakan elemen induktif potensial dari kabel dan komponen lainnya.
Gambar 4f menunjukkan hasil pemasangan melalui model rangkaian ekivalen yang diperoleh untuk sel-sel ini. Sel NFA-CA(‒)||NFA-CA(+) memiliki R ohmik terendah sebesar 159 mΩ cm 2 , dibandingkan dengan 196 mΩ cm 2 untuk sel Pt/C(‒)||IrO 2 (+) dan 223 mΩ cm 2 untuk sel NA-CA(‒)||NA-CA(+). Pengurangan kehilangan ohmik dapat dikaitkan dengan berkurangnya konsentrasi gelembung terperangkap di antara elektroda, sementara itu resistansi celah mikro yang lebih rendah disebabkan oleh keterbasahan katalis NFA-CA yang lebih unggul. Selain itu, sel yang dirakit dengan elektroda Raney Ni yang didoping Fe menunjukkan penurunan yang dramatis dalam resistansi pemindahan muatan relatif terhadap elektroda Raney-Ni normal, dari 193 mΩ cm 2 untuk sel NA-CA(‒)||NA-CA(+) menjadi 64 mΩ cm 2 untuk sel NFA-CA(‒)||NFA-CA(+), sedangkan nilai R ct untuk sel Pt/C(‒)||IrO 2 (+) adalah 101 mΩ cm 2 . Ini menyiratkan bahwa katalis NFA-CA yang dikembangkan secara efektif mempromosikan kinetika reaksi HER/OER dan pada gilirannya mempercepat pemindahan muatan. Lebih jauh, aliran dua fase gas/cairan yang ditingkatkan memperlihatkan situs aktif yang lebih efisien, menghasilkan peningkatan pemindahan muatan yang signifikan. Selain itu, kapasitas perpindahan massa yang tinggi dalam sel NFA-CA(‒)||NFA-CA(+) terwujud karena R mt minimal sebesar 43 mΩ cm 2 , sedangkan sel NA-CA(‒)||NA-CA(+) lainnya dan sel Pt/C(‒)||IrO 2 (+) mencapai 139 dan 90 mΩ cm 2 .
Peningkatan perpindahan massa mungkin terkait dengan kelebihan potensial konsentrasi NFA-CA yang dilepaskan karena sifat hidrofiliknya. [ 49 , 50 ] Pada kerapatan arus tinggi, reaktan permukaan elektroda (seperti molekul air dan ion hidroksida) dikonsumsi dengan cepat, yang menghasilkan penurunan tajam dalam konsentrasi reaktan pada permukaan elektroda. Jika elektrolit tidak dapat berdifusi cukup cepat untuk mengisi kembali reaktan, gradien konsentrasi antara elektrolit dan permukaan elektroda meningkat, yang memperburuk polarisasi konsentrasi dan, dengan demikian, meningkatkan elemen impedansi terkait. Peningkatan keterbasahan permukaan NFA-CA secara substansial meningkatkan kapasitas ekstensi elektrolit dan mempercepat pengangkutan reaktan ke setiap situs aktif. Selain itu, keterbasahan yang tinggi berkontribusi pada pelepasan gelembung gas yang lebih cepat dari permukaan elektroda, yang mengurangi penutup dan topeng gelembung gas, sehingga meningkatkan area kontak antara elektrolit dan katalis dan meningkatkan efisiensi perpindahan massa dari keseluruhan sel AEM. EIS pada rapat arus rendah 0,1 A cm −2 telah dilakukan (seperti ditunjukkan pada Gambar S8 , Informasi Pendukung), yang memperlihatkan nilai resistansi ohmik yang serupa dengan konfigurasi sel NA-CA, yang selanjutnya mengonfirmasi bahwa elektroda NFA-CA dapat secara efektif mengelola pelepasan gelembung pada rapat arus yang lebih tinggi (2 A cm −2 ), mengoptimalkan resistansi ohmik yang disebabkan oleh penahanan gelembung untuk sel elektroliser AEM.
Kami juga membandingkan kinerja sel di bawah rapat arus 1 A cm −2 dari elektroda NFA-CA yang dikembangkan dengan kinerja sebagian besar karya mutakhir yang dilaporkan. Hebatnya, kinerja ini sudah mengungguli sebagian besar dari mereka, sebagaimana dibuktikan dalam Gambar 4g . Dalam aplikasi industri praktis, stabilitas katalis juga memainkan peran penting. Oleh karena itu, sel NFA-CA(–)||NFA-CA(+) dioperasikan terus-menerus selama 1000 jam dalam kondisi galvanostatik 1,0 A cm −2 . Menurut hasil dalam Gambar 4h , tegangan sel setelah 1000 jam operasi dalam sel elektroliser AEM tidak menunjukkan peningkatan yang nyata dibandingkan dengan tegangan sel awal, meskipun ada beberapa fluktuasi yang disebabkan oleh perilaku gelembung gas. Citra optik elektroda NFA-CA setelah uji ketahanan 1000 jam ditunjukkan dalam Gambar S9 (Informasi Pendukung). Hal ini menyoroti ketahanan sel NFA-CA(–)||NFA-CA(+) yang luar biasa tanpa penurunan kinerja untuk operasi jangka panjang pada kepadatan arus tinggi tingkat industri. Namun, elektroliser AEM (Pt/C(–)||IrO 2 (+)) berdasarkan elektroda acuan yang dirakit dengan katalis logam mulia Pt/C sebagai katode dan IrO 2 sebagai anoda menunjukkan penurunan kinerja sel yang signifikan setelah 150 jam operasi di bawah 1,0 A cm −2 .
Untuk lebih membenarkan stabilitas katalis NFA-CA, morfologi dan komposisi setelah 1000 jam operasi dalam elektroliser AEM dikarakterisasi dengan XRD, SEM, dan TEM. Gambar S10 (Informasi Pendukung) menunjukkan bahwa katalis NFA-CA mengalami perubahan fase yang dapat diabaikan setelah 1000 jam operasi jangka panjang dalam sel AEM. Selain itu, morfologi dan komposisinya sebagian besar tetap tidak berubah, sebagaimana dibuktikan oleh Gambar S11–S14 dan Tabel S5 (Informasi Pendukung). Fakta-fakta ini mendukung stabilitas NFA-CA yang memadai. Selain itu, kami memeriksa nanostruktur dan komposisi elektroda NFA-CA setelah 1000 jam operasi menggunakan analisis TEM. Gambar S15a–f (Informasi Pendukung) menyajikan gambar HR-TEM untuk sampel pasca-HER dan pasca-OER, masing-masing. Hasilnya menunjukkan bahwa heterostruktur nanokristal NiFe-hidroksida NiFe yang khas tetap terpelihara dengan baik dibandingkan dengan elektroda murni (Gambar 1f,g ), membantu mempertahankan aktivitas katalitik yang tinggi bahkan setelah 1000 jam uji stabilitas. Selain itu, elektroda pasca-HER dan pasca-OER mempertahankan inti logamnya dengan lapisan aktif yang ditutupi, mirip dengan elektroda murni (Gambar 1d ), yang berkontribusi pada stabilitas jangka panjangnya. Sinyal NiAl juga dideteksi dalam sampel pasca-operasi menggunakan mode TEM-FFT (Gambar S15c,f , Informasi Pendukung), yang mengonfirmasi stabilitasnya dalam lingkungan alkalin. Fitur ini memungkinkan NiAl berfungsi sebagai kerangka struktural untuk elektroda berbasis Raney-Ni. [ 31 , 33 ] Analisis TEM-EDS (Tabel S6 , Informasi Pendukung) juga mengungkapkan sedikit peningkatan kandungan oksigen dalam elektroda pasca-operasi dibandingkan dengan yang murni. Peningkatan ini disebabkan oleh rekonstruksi katalis dan penambahan KOH selama operasi HER/OER yang berkepanjangan.
Perilaku pelarutan Ni, Fe, dan Al dalam elektrolit selama operasi jangka panjang sel AEM yang dilengkapi dengan NFA-CA pada 1,0 A cm −2 dianalisis melalui ICP, seperti yang ditunjukkan pada Tabel S7 . Hasilnya menunjukkan bahwa elektroda NFA-CA menjalani rekonstruksi dalam 10 jam pertama, setelah itu komposisinya stabil setelah 50 jam operasi, menunjukkan ketahanan korosi dan stabilitas jangka panjang yang luar biasa. Efisiensi produksi H2 dan O2 dari elektroliser AEMWE yang dilengkapi dengan elektroda NFA-CA dilakukan, seperti yang ditunjukkan pada Gambar S16 (Informasi Pendukung). Hasil menunjukkan bahwa efisiensi produksi H2 dan O2 untuk konfigurasi sel elektroda NFA-CA mendekati 100%. Kromatografi gas (GC) yang dilengkapi dengan detektor konduktivitas termal (TCD) digunakan untuk mengukur komposisi H₂ dan O₂ di setiap kompartemen. H₂ yang terdeteksi dalam aliran O₂ (HTO) sekitar 0,23%, sedangkan O₂ yang terdeteksi dalam aliran H₂ (OTH) adalah 0,08%. Hasil ini menunjukkan bahwa perpindahan gas relatif kecil dalam kondisi pengujian kami tetapi masih tidak dapat diabaikan. Singkatnya, elektroda NFA-CA yang menampilkan aktivitas katalitik dan stabilitas yang unggul menggarisbawahi potensi yang cukup besar untuk aplikasi elektroliser AEM industri.
2.4 Analisis Dinamika Kebasahan dan Gelembung H 2
Dalam aplikasi praktis elektrolisis air AEM pada rapat arus tinggi, banyak gelembung gas biasanya dihasilkan. Gelembung-gelembung ini sering gagal lepas dengan cepat, yang menyebabkan permukaan elektroda tertutup. Situasi ini menyebabkan peningkatan signifikan resistansi ohmik, resistansi perpindahan muatan, dan resistansi perpindahan massa, yang khususnya akut dalam konfigurasi elektroliser air AEM dengan desain celah nol, di mana transportasi ion yang efisien sangat bergantung pada aliran elektrolit. [ 31 , 32 , 50 , 73 – 76 ] Seperti yang ditunjukkan oleh analisis EIS in situ, resistansi sel NFA-CA(‒)||NFA-CA(+) yang sangat optimal terutama dikaitkan dengan perpindahan muatan yang ditingkatkan, hambatan transportasi massa yang lebih sedikit, dan penyerapan/desorpsi zat antara yang lebih baik. Namun, keterbasahan permukaan dan mekanisme pelepasan gelembung gas akan menjadi faktor kunci lain yang memengaruhi resistansi ohmik, resistansi perpindahan muatan, dan resistansi perpindahan massa untuk sel elektroliser air AEM dalam rapat arus yang relevan dengan industri. Oleh karena itu, penting untuk melakukan analisis menyeluruh terhadap kebasahan permukaan dan perilaku pelepasan gelembung untuk elektroda yang dikembangkan ini.
Seperti yang ditunjukkan pada Gambar 5a,b , katalis NA-CA menunjukkan sifat hidrofilik dengan sudut kontak 48°, sementara katalis NFA-CA menunjukkan hidrofilisitas tinggi yang mencapai sudut kontak mendekati nol. Dari rekaman video, tetesan air pada permukaan NFA-CA menyebar pada kecepatan yang sangat cepat dan sepenuhnya terinfiltrasi dalam 0,25 detik, sementara NA-CA memerlukan waktu yang jauh lebih lama yaitu 38,28 detik untuk mencapai difusi tetesan air yang lengkap, seperti yang dibuktikan pada Gambar S17 , dan Video S1 dan S2 (Informasi Pendukung). Superhidrofilisitas yang ditingkatkan dalam katalis NFA-CA membantu difusi elektrolit yang seragam melintasi katalis dan mengurangi kemungkinan hambatan bagi reaktan untuk mencapai situs aktif. Peningkatan hidrofilisitas dapat meningkatkan perilaku dinamis gelembung dan pada gilirannya memfasilitasi pelepasan gelembung gas, [ 32 , 77 ] dengan demikian, membebaskan situs aktif dan mengurangi segala keterbatasan transpor elektron dan perpindahan massa yang disebabkan oleh akumulasi gelembung gas. Selain itu, pelepasan gelembung yang lebih cepat ini juga berdampak pada resistansi ohmik sel karena lebih cepatnya pembuangan gas isolasi dari permukaan.
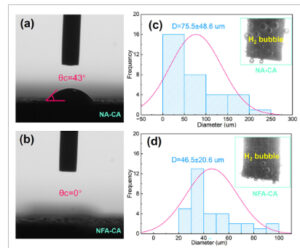
Gambar 5
Buka di penampil gambar
Presentasi PowerPoint
a) Pengukuran sudut kontak NA-CA; b) Pengukuran sudut kontak NFA-CA. Diameter rata-rata gelembung gas H 2 yang dihasilkan pada elektroda c) NA-CA dan d) NFA-CA, sisipkan: Gambar kamera pelepasan gelembung H 2 dari elektroda yang dibuat.
Kamera digunakan untuk mendokumentasikan proses pemisahan air dan memeriksa distribusi ukuran dan perilaku pelepasan gelembung gas yang dihasilkan pada berbagai elektroda pada kerapatan arus 50 mA cm −2 . Histogram distribusi ukuran gelembung H₂ (Gambar 5c,d ) menunjukkan bahwa gelembung H₂ yang dilepaskan dari NFA-CA (46,5 ± 20,6 µm) jauh lebih kecil daripada gelembung dari NA-CA (75,5 ± 48,6 µm), yang menyiratkan bahwa elektroda NFA-CA memiliki sifat aerofobik yang ditingkatkan, yang memfasilitasi pelepasan gelembung gas dengan mudah. Gelembung gas yang lebih besar dapat menghalangi luas permukaan elektroda dan memerlukan gaya pelepasan yang lebih besar, yang menyebabkan peningkatan resistensi difusi dan kelebihan potensial selama proses pemisahan air. [ 78 ] Hasilnya, struktur inti-kulit nanokristal NiFe-hidroksida NiFe yang unik pada permukaan elektroda NFA-CA meningkatkan karakteristik hidrofilik dan aerofobiknya, yang secara efektif memfasilitasi desorpsi gelembung gas dari permukaan elektroda. Hal ini dapat meningkatkan kontak antarmuka dan transportasi massa sekaligus meningkatkan transfer muatan karena paparan situs aktif yang lebih banyak. Akibatnya, sel AEM yang dibangun dengan elektroda NFA-CA menunjukkan peningkatan yang jelas dalam perilaku sel secara keseluruhan, yang sejalan dengan analisis dari pengukuran EIS in situ.
3 Kesimpulan
Karya ini merancang dan mengembangkan elektrokatalis Raney-Ni yang memodulasi Fe yang disiapkan dengan APS dan etsa kimia. Dengan mengatasi masalah konduktivitas elektron yang lebih rendah dan stabilitas yang terkait dengan katalis hidroksida NiFe konvensional, katalis NFA-CA menghasilkan aktivitas katalitik yang tinggi dan stabilitas yang cukup baik. Spesies nanokristalin hidroksida NiFe tumbuh pada nanokristalin NiFe, yang didukung oleh kerangka NiAl yang kuat dan tahan terhadap basa kuat. Paduan NiFe dan NiAl dalam katalis memberikan konduktivitas tinggi yang memfasilitasi transpor elektron yang cepat. Hasil XANES dan FT-EXAFS menunjukkan bahwa Fe berhasil didoping ke Raney-Ni, yang ada dalam bentuk struktur inti-kulit nanokristalin NiFe–nanokristalin hidroksida NiFe. Hal ini pada gilirannya mendorong transpor elektron dan jumlah situs aktif Ni dalam nanokristalin hidroksida NiFe karena koordinasi tak jenuh yang diperluas, sehingga meningkatkan aktivitas katalitik total elektroda NFA-CA. Dengan demikian, elektroda NFA-CA mencapai aktivitas katalitik dan daya tahan yang cukup besar terhadap HER dan OER. Selain itu, sel elektroliser air AEM yang dilengkapi dengan elektroda NFA-CA hanya memerlukan 1,56 V dalam 1 M KOH dan 60 °C untuk mencapai kerapatan arus 1,0 A cm −2 . Selain itu, elektroda yang dikembangkan menunjukkan daya tahan yang sangat baik untuk 1000 jam operasi di bawah kerapatan arus skala industri 1,0 A cm −2 , dengan tanda-tanda degradasi mikrostruktur. Selain itu, sel AEM mencapai 2 A cm −2 hanya pada 1,79 V, yang melebihi target Departemen Energi Amerika Serikat untuk sistem AWE sebesar 1,80 V. Desain inovatif ini menyajikan metode yang dapat diskalakan dan merupakan kemajuan signifikan dalam mengejar teknologi elektrolisis air industri generasi berikutnya.

