
Abstrak
Studi ini menyajikan elektrolit polimer padat berbasis poliuretan zwitterionik polimer-dalam-garam (PIS) baru (zPU-SPE) yang menawarkan konduktivitas ionik tinggi, interaksi kuat dengan elektroda, dan stabilitas mekanis dan elektrokimia yang sangat baik, sehingga menjanjikan untuk baterai litium solid-state berkinerja tinggi (ASSLB). zPU-SPE menunjukkan konduktivitas ion litium (Li + ) yang luar biasa (3,7 × 10⁻⁴ S cm −1 pada 25 °C), yang dimungkinkan oleh pemuatan garam yang sangat tinggi hingga 90 wt.% (rasio molar garam Li terhadap unit polimer 12,6) tanpa pemisahan fase. Ini mengatasi keterbatasan SPE konvensional dengan menggabungkan konduktivitas ionik tinggi dengan nomor transferensi Li + 0,44, yang dicapai melalui penggabungan gugus zwitterionik yang meningkatkan disosiasi dan transportasi ion. Energi permukaan yang tinggi (338,4 J m − 2 ) dan elastisitas memastikan adhesi yang sangat baik pada anoda Li, mengurangi resistansi antarmuka dan memastikan fluks Li + yang seragam . Ketika diuji dalam sel Li||zPU||LiFePO₄ dan Li||zPU||S/C, zPU-SPE menunjukkan stabilitas siklus yang luar biasa, mempertahankan kapasitas 76% setelah 2000 siklus dengan katode LiFePO 4 , dan mencapai retensi kapasitas 84% setelah 300 siklus dengan katode S/C. Simulasi molekuler dan berbagai karakterisasi eksperimental mengonfirmasi organisasi struktural superior dari matriks zPU, yang berkontribusi pada kinerja elektrokimianya yang luar biasa. Temuan tersebut sangat menyarankan bahwa zPU-SPE adalah kandidat yang menjanjikan untuk ASSLB generasi berikutnya.
1 Pendahuluan
Komersialisasi baterai litium (LB) menandai tonggak penting dalam evolusi teknologi penyimpanan energi, yang mendukung berbagai aplikasi, termasuk perangkat elektronik portabel, kendaraan listrik, dan penyimpanan energi skala besar. [ 1 ] Baterai logam litium (LMB) disukai karena kepadatan energinya yang tinggi, tegangan kerja yang tinggi, siklus masa pakai yang sangat baik, dan tingkat pengosongan daya sendiri yang rendah. [ 2 ] Meskipun memiliki keunggulan ini, LMB konvensional yang menggunakan elektrolit cair organik memiliki tantangan keamanan yang signifikan, termasuk reaksi samping yang tidak terkendali, pembentukan dendrit litium (Li), dan sifat mudah terbakar yang tinggi. [ 3 ] Masalah keamanan ini telah membatasi penyebaran LMB yang lebih luas, sehingga mendorong peningkatan permintaan akan alternatif yang lebih aman dan lebih stabil. LB semua-padat (ASSLB) muncul sebagai solusi yang menjanjikan, menawarkan keamanan baterai yang lebih baik dan kemungkinan peningkatan siklus masa pakai.
Elektrolit solid-state anorganik (IE) adalah kandidat yang menjanjikan untuk ASSLB karena konduktivitas ion litium (Li + ) yang tinggi, selektivitas kation yang tinggi, stabilitas elektrokimia yang unggul, stabilitas termal, dan kemampuan untuk menekan pertumbuhan dendrit. [ 4 ] Meskipun demikian, adopsi penuh mereka dalam LMB telah terhambat oleh kerapuhan dan kerapuhan yang melekat, ditambah dengan kompatibilitas antarmuka yang buruk dengan elektroda. [ 3 ] Sebaliknya, elektrolit polimer padat (SPE) menawarkan fleksibilitas dan elastisitas yang lebih baik, kontak antarmuka yang lebih baik dengan elektroda, dan kemudahan pemrosesan, yang secara terus-menerus menarik minat yang signifikan di lapangan. [ 5 ] Namun, SPE konvensional mengalami konduktivitas ionik suhu kamar yang rendah dan selektivitas kation yang rendah (t + < 0,2). [ 6 ] Banyak modifikasi telah diusulkan untuk meningkatkan sifat elektrokimia SPE konvensional, seperti menggabungkan pengisi anorganik atau logam-organik, menambahkan plasticizer, kopolimerisasi, dan pencampuran polimer. [ 7 ] Meskipun ada upaya-upaya ini, mencapai semua karakteristik yang diinginkan dari elektrolit padat dalam SPE garam-dalam-polimer tradisional (SIP-SPE), dengan pemuatan massa garam Li yang khas < 50%, [ 1 , 8 ] tetap menjadi tantangan yang signifikan, terutama karena konduktivitas ionik yang rendah. [ 2 ] Desain SIP-SPE biasanya bergantung pada polimer yang melarutkan garam ionik melalui gugus polar dan mengangkut Li + secara vehicular melalui gerakan segmental polimer. Namun, proses solvasi dan pengangkutan ion dalam SIP-SPE ini memiliki kekurangan yang melekat, termasuk pengangkutan kation logam yang terbatas karena gerakan kation yang melambat yang disebabkan oleh koordinasi kation-polimer yang kuat. Untuk mengatasi masalah konduktivitas ionik rendah dari SIP-SPE, polimer-dalam-garam SPE (PIS-SPE), dengan > 50% pemuatan massa garam Li, telah diselidiki, di mana mekanisme transpor hopping Li + berkontribusi pada konduktivitas ionik. [ 9 ] Dalam PIS-SPE, pemuatan garam Li yang tinggi mendorong pembentukan agregat garam, yang memungkinkan ion logam berdifusi melalui agregat anion yang saling berhubungan, sementara polimer memberikan stabilitas mekanis. Desain ini dapat sangat meningkatkan difusi Li + dengan memisahkan gerakan ion logam dari dinamika polimer (misalnya, gerakan segmental, relaksasi rantai). [ 10 ] Upaya sebelumnya terutama menggunakan polimer tradisional seperti PEO, [ 11 ] PAN, [ 12 ] atau PVDF, [ 13 ] yang menunjukkan konduktivitas ionik dan kinerja LMB yang tidak memuaskan pada suhu kamar karena keseimbangan yang tidak optimal antara stabilitas mekanis, kimia, elektrokimia, interaksi dengan elektroda, dan konduktivitas ionik. Keterbatasan ini menghambat kemampuan untuk mencapai siklus stabil jangka panjang pada suhu ruangan. Dengan demikian, ada permintaan yang jelas untuk mengeksplorasi kimia baru untuk pemisahan solvasi rantai samping yang efisien dan strategi penjebakan anion, dan pemahaman yang lebih mendalam tentang mekanisme transpor ion dalam polimer penghantar ion untuk memenuhi berbagai persyaratan kinerja SPE.
Untuk mengatasi tantangan SPE konvensional, para peneliti telah mengusulkan elektrolit polimer zwitterionik (ZI). ZI telah banyak digunakan sebagai aditif untuk ASSLB konvensional untuk meningkatkan difusivitas ion. [ 14 ] Polimer ZI didefinisikan sebagai polimer yang memiliki jumlah molar yang sama dari gugus anionik dan kationik yang terdistribusi secara homogen di sepanjang rantai polimernya. [ 15 ] Meskipun netral muatan, polimer ZI memiliki momen dipol yang besar dan dapat berinteraksi dengan ion, mendorong disosiasi ion dan memfasilitasi transpor ion. [ 16 ] Elektrolit polimer ZI yang dikembangkan terutama melibatkan polimerisasi atau kopolimerisasi ZI metakrilat. Elektrolit polimer ZI yang dihasilkan menunjukkan sifat transpor ionik yang lebih tinggi daripada SPE konvensional, meskipun belum pada tingkat yang diinginkan. [ 17 ] Akibatnya, desain elektrolit polimer ZI keadaan padat yang memenuhi kriteria kinerja komprehensif ASSLB masih diperlukan.
Dalam studi ini, kami memperkenalkan PIS-SPE baru berdasarkan ZI poliuretana SPE (zPU-SPE) untuk ASSLB yang mengatasi keterbatasan bahan SPE konvensional, seperti konduktivitas ionik rendah, kontak buruk dengan elektroda, dan stabilitas mekanis dan elektrokimia terbatas. Kami mensintesis zPU [yaitu, poli((dietanolamin etil asetat)-ko-(1,6-diisosianatoheksana))] dan menunjukkan kemampuannya untuk menampung rasio mol Li + /ZI tinggi hingga 12,6 (90 wt.%) litium bis(trifluorometanasulfonil)imida (LiTFSI) tanpa pemisahan fase garam Li dan polimer. Konduktivitas ionik zPU-SPE pada suhu 25 °C adalah 3,7 × 10 −4 S cm −1 , dua kali lipat lebih besar daripada (1,9 × 10 −6 S cm −1 ) poli(etilen oksida) (PEO) SPE (Li + /EO = 1/16). Selain itu, energi permukaan zPU-SPE yang tinggi meminimalkan resistansi antarmuka. Kami mengevaluasi kinerja siklus menggunakan sel Li||zPU||LiFePO 4 (1 C pada suhu 25 °C) dan Li||zPU||S/C (0,3 C pada suhu 25 °C). Kedua sel LB dengan zPU-SPE menunjukkan stabilitas siklus yang luar biasa, dengan retensi kapasitas 77% setelah 2000 siklus untuk katode LiFePO4 dan retensi kapasitas 84% setelah 300 siklus untuk katode S/C, sambil mempertahankan efisiensi coulombik ≈100%. Kami juga melakukan pemodelan molekuler atomistik untuk menyelidiki solvasi garam Li dan interaksi garam Li-zPU, yang memberikan wawasan tentang transportasi Li + dalam matriks polimer zPU. Lebih jauh, kami menggunakan hamburan sinar-X sudut kecil (SAXS) untuk memeriksa organisasi struktural matriks zPU-SPE dan korelasinya dengan konduktivitas ion. Pekerjaan kami bertujuan untuk memandu desain elektrolit polimer baru yang mampu mengatasi trade-off yang terkait dengan polimer penghantar ion.
2 Hasil
2.1 Pembuatan zPU-SPE
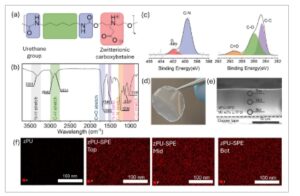
Gambar 1a mengilustrasikan struktur kimia skematik zPU yang disintesis. Dalam zPU, kepadatan tinggi ikatan hidrogen antar dan intramolekul antara gugus uretan, yang digabungkan dengan tumpukan segmen 1,6 Diisocyanatohexane (HDI) yang kaku, berkontribusi secara signifikan terhadap sifat termal dan mekanis zPU. Gugus karboksibetain ZI dapat melarutkan LiTFSI secara efektif, yang memungkinkan difusi Li + yang cepat . Kimianya memaksimalkan mobilitas ion dengan menyediakan interaksi coulombik yang penting untuk memisahkan pasangan ion garam sambil menyeimbangkan solvasi dan disosiasi ion, [ 18 ] menghindari penjebakan Li + dan difusivitas yang rendah. Selain itu, gugus karboksibetain telah dilaporkan memiliki kompatibilitas yang lebih tinggi dengan anoda Li dibandingkan dengan gugus sulfobetaine dan betaine fosfat. [ 18 ] Seperti yang diilustrasikan pada Gambar S1a (Informasi Pendukung), karboksibetain zPU disintesis melalui polikondensasi prekursor ZI (DEAEA) dengan HDI, diikuti oleh hidrolisis etil ester untuk menghasilkan gugus karboksibetain ZI. DEAEA dipilih sebagai pemanjang rantai dan prekursor ZI. Sintesis karboksibetain zPU yang berhasil dengan berat molekul ≈10k (Gambar S1b , Informasi Pendukung) dikonfirmasi oleh 1 H NMR dan 13 C NMR, seperti yang ditunjukkan pada Gambar S1c,d (Informasi Pendukung). Komposisi kimia zPU dikarakterisasi menggunakan analisis ATR-FTIR (Gambar 1b ). Pita serapan penting untuk peregangan N─H, peregangan C─H, peregangan C ═ O, peregangan C─O─C, dan pembengkokan N─H diamati masing-masing pada 3324, 2940–2854, 1696, 1105–1147, dan 1540 cm −1 . Selain itu, spektrum pemindaian survei XPS dari zPU menunjukkan puncak O1s, N1s, dan C1s (Gambar 1c ). Puncak N1s pada 399,8 eV sesuai dengan ikatan C─N dalam gugus uretana, sedangkan puncak pada 402,0 eV dapat dikaitkan dengan amina kuartener dalam gugus karboksibetain zwitterionik. Spektrum C1s menunjukkan tiga puncak karakteristik pada 284,4, 285,6, dan 289,1 eV, yang ditetapkan untuk atom karbon dalam hidrokarbon jenuh (─C─C─), atom karbon yang berikatan dengan oksigen (─C─O─), dan atom karbon dalam gugus uretan dan karboksibetain (─C ═ O─). Hasil ini, yang didukung oleh analisis ATR-FTIR, mengonfirmasi keberhasilan sintesis zPU yang menggabungkan ZIs karboksibetain.
Gambar 1
Buka di penampil gambar
Presentasi PowerPoint
a) Struktur molekul zPU. b) Spektroskop FT-IR zPU. c) Kurva XPS zPU. d) Gambar zPU-SPE yang difabrikasi. e) Gambar SEM penampang zPU-SPE. f) Gambar SEM-EDX zPU dan zPU-SPE dengan muatan LiTFSI 90 wt.%. Bagian atas, tengah, dan bawah menunjukkan tiga area penampang zPU-SPE yang berbeda.
zPU-SPE disiapkan dengan menghamili larutan LiTFSI ke dalam film zPU, dan selanjutnya menghilangkan pelarut melalui pengeringan vakum. Tidak adanya residu pelarut dalam zPU-SPE selanjutnya diverifikasi menggunakan TGA, dengan zPU sebagai referensi (Gambar S1e , Informasi Pendukung). Kurva termogravimetri derivatif (DTG) dari zPU dan zPU-SPE mengonfirmasi bahwa zPU-SPE yang disiapkan mengandung residu pelarut volatil yang minimal. Dalam studi ini, kami menggunakan LiTFSI karena merupakan garam yang sangat labil yang dapat dengan mudah terdisosiasi dengan adanya fungsionalitas pemecahan ion. [ 17 ] Gambar 1d menunjukkan foto zPU-SPE yang disiapkan yang digunakan dalam fabrikasi ASSLB. Sebagai catatan, proses fabrikasi ASSLB kami dengan zPU-SPE tidak memerlukan polimerisasi in situ yang rumit atau pasca-fungsionalisasi selama perakitan baterai, sehingga memungkinkan perakitan rol-ke-rol ASSLB berbasis SPE. Gambar 1e,f menyajikan gambar SEM dari penampang melintang zPU-SPE yang telah disiapkan (90 wt.% dari muatan LiTFSI). Muatan garam yang berlebih atau solvasi garam yang tidak mencukupi dalam polimer dapat menyebabkan presipitasi garam dan fase kristal garam dengan daya hantar ion yang buruk. [ 19 ] Untuk memeriksa homogenitas dispersi LiTFSI dalam matriks zPU, kami menilai distribusi elemen menggunakan SEM-EDX. Untuk polimer zPU tanpa penambahan LiTFSI, tidak ada sinyal fluor (F) yang terdeteksi karena tidak adanya F dalam rantai polimer zPU. SEM-EDX dengan jelas menunjukkan distribusi F yang seragam (dari LiTFSI) di kedua permukaan dan daerah tengah zPU-SPE setelah impregnasi LiTFSI. Lebih jauh, tidak ada segregasi fase skala mikron yang diamati dalam zPU-SPE. Karbon (C), nitrogen (N), dan sulfur (S) juga menunjukkan distribusi yang homogen (Gambar S2 , Informasi Pendukung). Gambar SEM-EDX ini menunjukkan distribusi LiTFSI yang seragam dalam zPU-SPE.
Perlu dicatat bahwa PU umumnya dianggap sebagai bahan pemisah fase. Hal ini disebabkan oleh struktur inheren PU, yang biasanya terdiri dari segmen keras dan lunak, yang interaksinya dapat menimbulkan pemisahan mikrofase. [ 20 ] Struktur karakteristik SPE berbasis PU yang khas ini menghasilkan pembentukan fase kaku, yang umumnya dikaitkan dengan konduktivitas ionik yang lebih rendah. Meskipun demikian, hal ini diimbangi oleh keberadaan fase fleksibel dalam PU, yang sering kali berkontribusi pada peningkatan transportasi ion. [ 21 ] Menariknya, morfologi fase ganda seperti itu tidak ada dalam zPU-SPE, yang dikaitkan dengan diol dan diisosianatnya yang pendek. Selain itu, zPU-SPE kami adalah sistem PIS-SPE dan mengandung muatan garam tinggi hingga rasio LiTFSI/ZI sebesar 12,6 (90 wt.% garam LiTFSI dalam zPU-SPE), yang menunjukkan bahwa mekanisme transportasi ionnya sangat bergantung pada difusi permukaan melalui agregat anion yang saling berhubungan. Telah diketahui bahwa pada pemuatan garam Li tinggi di atas 50 wt.%, agregasi LiTFSI regional, dan kristalisasi dapat terjadi, yang dapat menghambat transpor ion dan dengan demikian mengurangi konduktivitas ionik keseluruhan. [ 11 ] Namun demikian, zPU-SPE kami menunjukkan kemampuan luar biasa untuk impregnasi LiTFSI tinggi, tanpa menunjukkan daerah agregat LiTFSI bahkan pada pemuatan garam tinggi sebesar 90 wt.%.
2.2 Karakterisasi zPU-SPE
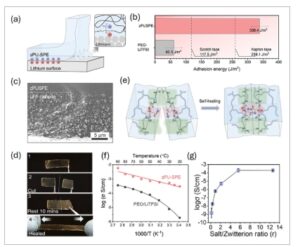
Adhesi antara elektrolit dan anoda Li berdampak signifikan terhadap kinerja LMB. [ 22 ] Kontak yang ditingkatkan antara elektroda dan zPU-SPE mengurangi resistansi antarmuka, memfasilitasi profil konsentrasi Li⁺ yang lebih seragam di antarmuka, dan dengan demikian meningkatkan transpor Li⁺. [ 23 ] Adhesi yang buruk di antarmuka selama pengupasan logam Li bertanggung jawab atas resistansi penyempitan dan titik panas yang dapat memfasilitasi propagasi dan kegagalan dendrit. Kami mengevaluasi energi adhesi permukaan antara zPU-SPE dan foil Li menggunakan uji pengelupasan ( Gambar 2a ; Gambar S3 , Informasi Pendukung). Khususnya, seperti yang ditunjukkan pada Gambar 2b , zPU-SPE menunjukkan sifat adhesi yang luar biasa pada logam Li, menunjukkan energi adhesi permukaan sebesar 338,4 J m −2 . Energi adhesi permukaan yang tinggi ini ≈5 kali lebih tinggi daripada PEO-SPE tradisional dan bahkan melampaui pita perekat sensitif tekanan yang tersedia secara komersial, seperti Kapton dan pita Scotch. Adhesi yang tinggi tersebut dapat menghasilkan profil konsentrasi Li + yang lebih seragam pada antarmuka zPU-SPE dan anoda Li serta kerapatan arus yang terdistribusi dengan baik. [ 22 ] Eksperimen dan studi simulasi telah menunjukkan bahwa peningkatan adhesi dapat secara efektif menekan pertumbuhan dendrit Li, yang sangat diinginkan dalam ASSLB. [ 22 , 24 ] Setelah kontak dengan permukaan foil Li, ZI bermuatan dalam zPU-SPE menghasilkan tarikan elektrostatik dan interaksi Van der Waals yang kuat, sehingga meningkatkan ikatan zPU-SPE yang cepat dan kuat ke anoda Li. [ 22 , 25 ] Selain itu, kerapatan ikatan hidrogen yang lebih tinggi dari gugus uretan berkontribusi pada adhesi dan kohesi yang kuat di dekat antarmuka. [ 25 ] Sifat perekat yang kuat juga mendapat manfaat dari elastisitas zPU-SPE. Sifat termoplastik zPU-SPE yang lembut dapat meningkatkan area kontak dengan permukaan logam Li karena deformasi zPU-SPE selama kontak dan kompresi. [ 25 ] Gambar SEM katode LFP yang diinfiltrasi dengan zPU-SPE (Gambar 2c ) menunjukkan kontak antarmuka yang seragam, bebas dari rongga atau delaminasi. Antarmuka yang kuat ini dihasilkan dari energi adhesi permukaan zPU-SPE yang tinggi, yang memastikan pembasahan dan pengikatan yang efisien. Kontak yang erat tersebut meminimalkan resistensi antarmuka dan memungkinkan pengangkutan ion yang stabil, yang mengonfirmasi kompatibilitas mekanis zPU-SPE dengan katode dan potensinya untuk stabilitas siklus jangka panjang dalam ASSLB.
Gambar 2
Buka di penampil gambar
Presentasi PowerPoint
a) Ilustrasi mekanisme adhesi zPU-SPE pada permukaan logam litium. b) Energi adhesi permukaan zPU-SPE dengan logam litium dibandingkan dengan PEO-SPE tradisional, pita perekat, dan pita perekat Kapton. c) Gambar penampang lintang katode LFP yang diinfiltrasi zPU-SPE. d) Fotografi proses penyembuhan segel zPU-SPE. e) Ilustrasi mekanisme penyembuhan zPU-SPE. f) Ketergantungan suhu konduktivitas ionik untuk zPU-SPE dibandingkan dengan PEO-LiTFSI. g) Nilai konduktivitas ion sebagai fungsi rasio molar LiTFSI/ZI.
Bahasa Indonesia: Selain adhesi antarmuka yang sangat baik, sifat penyembuhan diri zPU-SPE juga dapat membantu memperpanjang umur siklus di ASSLB. Deposisi Li umumnya menyebabkan retakan pada SPE tradisional selama penyisipan dan ekstraksi Li + berulang dalam proses pengisian dan pengosongan, yang mengakibatkan pemendekan masa pakai ASSLB. [ 26 ] Sebagai perbandingan, zPU-SPE memiliki sifat penyembuhan diri melalui ikatan non-kovalen yang reversibel, yang memperpanjang masa pakai ASSLB dan meningkatkan stabilitas siklus setelah retakan atau deformasi. [ 27 ] Seperti yang ditunjukkan pada Gambar 2d , zPU-SPE dapat pulih ke bentuk aslinya dalam waktu 10 menit setelah dipotong menjadi dua, karena celahnya secara bertahap menghilang. zPU-SPE adalah material perbaikan diri yang otonom yang diwujudkan melalui jaringan supramolekulnya yang dibuat oleh interaksi non-kovalen, termasuk ikatan hidrogen dan interaksi dipol-dipol, seperti yang diilustrasikan pada Gambar 2e . Bahasa Indonesia: Setelah mengalami deformasi atau retak, gugus karboksibetain ZI pada antarmuka yang rusak berpasangan lagi melalui interaksi dipol-dipol untuk kembali ke keadaan semula. [ 28 ] Sementara itu, ikatan hidrogen juga terbentuk di antara gugus uretan. [ 29 ] Kedua jenis gaya tersebut bekerja sama untuk mencapai sifat penyembuhan diri yang sangat baik. Selain itu, DSC menunjukkan bahwa zPU memiliki suhu transisi gelas yang rendah yaitu −8 °C (Gambar S4 , Informasi Pendukung). Suhu transisi gelas tersebut berada di bawah suhu sekitar, yang membantu pergerakan rantai yang cepat dan penyembuhan diri zPU-SPE. [ 27 , 30 ]
Stabilitas elektrokimia zPU-SPE dan PEO-SPE diselidiki menggunakan voltametri sapuan linier (LSV) (Gambar S5 , Informasi Pendukung). Pengukuran LSV dilakukan pada suhu ruangan dalam sel SS||SPE||Li dengan laju pindai 0,1 V min −1 . Seperti yang ditunjukkan dalam pindaian anoda, timbulnya arus oksidasi untuk zPU-SPE diamati ≈4,25 V vs. Li/Li + . Arus ini dapat dikaitkan dengan dekomposisi oksidatif zPU oleh asam bis(trifluoromethanesulfonyl)imide (HTFSI) kuat yang terbentuk dari LiTFSI pada tegangan di atas 4,2 V vs. Li/Li + . [ 31 ] Stabilitas oksidatif zPU-SPE sebanding dengan PEO-SPE tradisional. Jendela tegangan yang diamati dalam LSV menunjukkan bahwa zPU-SPE stabil secara elektrokimia dan cocok untuk aplikasi dalam sel Li/LiFePO 4 dan Li/S. Meskipun stabilitas oksidatif zPU-SPE sebanding dengan PEO-SPE tradisional, peningkatan lebih lanjut diperlukan untuk aplikasi ASSLB pada tegangan tinggi. Penelitian yang sedang berlangsung berfokus pada eksplorasi berbagai garam litium, diol, dan segmen keras untuk meningkatkan kinerja zPU-SPE dalam kondisi tegangan tinggi.
Gambar 2f menunjukkan sifat konduktivitas ionik zPU-SPE dibandingkan dengan PEO-SPE pada suhu yang berbeda. Hasilnya menunjukkan bahwa zPU-SPE sebagian besar mengikuti model Arrhenius dalam jendela suhu 20—90 °C, sedangkan PEO-SPE mematuhi model Vogel–Falcher–Tammann (VFT). Perilaku non-linearitas dalam model VFT menunjukkan bahwa transpor ion dalam PEO-SPE dibantu oleh gerakan segmental polimer. [ 32 ] Sebagai perbandingan, hubungan seperti Arrhenius dalam zPU-SPE menunjukkan fakta bahwa transpor Li + tidak muncul dari gerakan molekuler polimer inang. Sebaliknya, transpor Li + dalam zPU-SPE dapat dikaitkan dengan ion yang melompat ke situs kosong terdekat (mekanisme lompatan ion), seperti dalam PIS-SPE dan elektrolit keramik anorganik. [ 32 ] Perilaku konduktivitas ionik dengan meningkatnya suhu di zPU-SPE menunjukkan mekanisme transpor pembeda yang berbeda dari SPE berbasis PEO tradisional. Dibandingkan dengan PEO-SPE, zPU-SPE menunjukkan konduktivitas ionik ≈200 kali lebih tinggi (3,7 × 10 −4 S cm −1 vs. 1,9 × 10 −6 S cm −1 ) pada suhu ruangan. Lebih jauh lagi, konduktivitas ionik zPU-SPE secara signifikan melebihi PU-SPE termoplastik yang dilaporkan sebelumnya tanpa gugus ZI. [ 33 ] Energi aktivasi konduktivitas ionik (E a ) ditemukan sebesar 0,14 eV untuk zPU-SPE, sebuah temuan penting mengingat SPE biasanya menunjukkan nilai E a yang lebih besar. E a yang lebih rendah untuk zPU-SPE menyiratkan mekanisme transpor ion yang khas dan efisien, [ 34 ] yang kami kaitkan dengan gugus ZI yang atraktif dan Li + . Ketika ZI dikombinasikan dengan LiTFSI, mereka membantu dalam disosiasi Li + dari klaster Li + /TFSI− , yang selanjutnya mengarah pada peningkatan baik dalam jumlah maupun mobilitas rata-rata Li + dalam matriks zPU-SPE. Selain itu, kami secara sistematis mempelajari perubahan konduktivitas ion zPU-SPE pada berbagai rasio molar LiTFSI/ZI ( r ): 0,2 (10 wt.% LiTFSI), 0,4 (20 wt.% LiTFSI), 0,9 (40 wt.% LiTFSI), 2,1 (60 wt.% LiTFSI), 5,6 (80 wt.% LiTFSI), dan 12,6 (90 wt.% LiTFSI). Seperti yang ditunjukkan pada Gambar 2g , hasilnya menunjukkan peningkatan konduktivitas ionik dengan peningkatan rasio LiTFSI/ZI dari 0,2 hingga 12,6. Penelitian sebelumnya juga melaporkan peningkatan konduktivitas ionik yang monoton pada polimer ZI pada berbagai konsentrasi garam. [ 17d] Meskipun r = 12,6 menghasilkan konduktivitas ionik tertinggi, untuk menyeimbangkan antara konduktivitas ionik dan sifat mekanis, kami mengadopsi r = 5,6 (80 wt.% LiTFSI) di sebagian besar perakitan dan evaluasi ASSLB.
Dalam aplikasi baterai, sangat penting untuk memaksimalkan t Li + , yang mewakili proporsi arus yang dibawa oleh Li + atas semua ion dalam elektrolit. SPE tradisional yang disiapkan menggunakan elektrolit cair organik dengan LiTFSI biasanya menunjukkan t Li + kurang dari 0,3. [ 35 ] Akibatnya, rasio tinggi anion lawan yang dapat bergerak (misalnya, TFSI − ) menyebabkan kerentanan yang lebih besar terhadap polarisasi konsentrasi. Anion bergerak ini dapat mengganggu pergerakan Li + dan mengganggu pengendapan Li + yang seragam pada permukaan elektroda, sehingga memperburuk pertumbuhan dendrit Li. [ 36 ] Kami melakukan uji kronoamperometri pada zPU-SPE pada suhu 30 °C, dan t Li + yang dihitung adalah 0,44 (Gambar S6 , Informasi Pendukung). Seperti yang ditunjukkan pada Gambar S7 (Informasi Pendukung), kinerja zPU-SPE kami sedikit lebih baik daripada batas atas universal yang dilaporkan oleh Balsara dan rekan kerja untuk elektrolit polimer. [ 37 ] t Li + yang lebih tinggi untuk zPU-SPE bermanfaat dalam mendorong aliran Li + yang lebih homogen dan menekan pembentukan dendrit Li. Dalam elektrolit penghantar ion ganda tradisional, Li + biasanya dikelilingi oleh molekul pelarut, gugus solvasi yang terikat pada polimer, atau gugus anion, yang dapat mengakibatkan gerakan Li + yang lebih lambat dibandingkan dengan anion. Namun, kami berspekulasi tentang mekanisme transpor ion yang khas dalam zPU-SPE. Dalam zPU-SPE, interaksi tarik-menarik antara gugus ZI dan Li + memfasilitasi disosiasi yang ditingkatkan dari agregasi gugus Li + /TFSI− . Akibatnya, lebih banyak Li + bebas dilepaskan untuk difusi cepat, sehingga menghasilkan t Li + yang lebih tinggi . [ 34 , 38 ] Walaupun dua SPE telah dilaporkan sebelumnya dengan konduktivitas ionik lebih tinggi dari 10 −3 S/cm dan jumlah transferensi lebih dari 0,75 dengan stabilitas siklus yang baik hingga 1000 siklus dalam LMB penuh, aplikasinya pada LMB mungkin terbatas karena persyaratan polimerisasi in situ dalam LMB [ 22 ] atau penggunaan terbatasnya sebagai lapisan pelindung antara anoda dan SPE. [ 39 ]
2.3 Mekanisme Pelarutan Garam dan Transportasi Ion di zPU-SPE
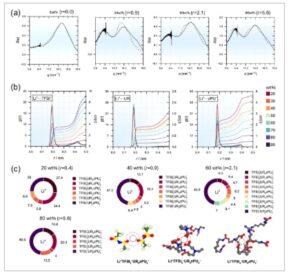
Konsentrasi garam Li yang relatif tinggi dalam SPE yang umum menghambat disosiasi garam Li dan mendorong pembentukan gugus ion karena lebih sedikit tempat solvasi oksigen dalam polimer (misalnya, PEO), yang secara signifikan menurunkan konduktivitas ion. [ 40 ] Untuk memahami miscibility zPU yang sangat baik dengan jumlah garam Li yang tinggi dan konduktivitas ionik yang tinggi bahkan pada rasio mol Li/ZI yang tinggi, efek solvasi garam Li (yaitu, LiTFSI) dalam zPU-SPE pada konduktivitas ion diselidiki dengan menggunakan simulasi dinamika molekuler (MD), SAXS, dan spektroskopi Raman. SAXS pertama kali dilakukan untuk memvalidasi kemampuan prediktif perhitungan MD dan untuk menyelidiki pengaturan struktural jarak jauh dalam zPU-SPE. Seperti yang ditunjukkan pada Gambar 3a dan S8a (Informasi Pendukung) (rentang konsentrasi LiTFSI penuh), kurva simulasi dan eksperimen berada dalam kesepakatan kualitatif yang tinggi, yang memungkinkan asal puncak pemesanan muatan untuk ditetapkan. Puncak yang terlihat pada ≈ 14,73 nm −1 mempertahankan intensitas dominan di seluruh rentang konsentrasi, yang sesuai dengan jarak antara atom-atom tetangga dari anion yang sama atau anion tetangga dalam polimer. Sementara itu, bahu sebelumnya pada ≈ 8,27 nm −1 yang tumbuh cepat dengan meningkatnya konsentrasi garam Li. Puncak yang terletak pada nilai q yang lebih rendah pada profil SAXS dikaitkan dengan pembentukan jaringan elektrostatik terurut jarak jauh antara ion bermuatan positif dan negatif (puncak pengurutan muatan). [ 41 ] Meningkatnya intensitas bahu, diikuti oleh pembentukan puncak, dapat dikaitkan dengan meningkatnya kemungkinan korelasi interionik yang dikecualikan dari kulit solvasi saat konsentrasi garam Li meningkat. [ 41 ] Karena puncak pertama pada 8,27 nm −1 sesuai dengan jarak karakteristik d = 2π/ q ≈ 0,73 nm, puncak ini selaras dengan periodisitas distribusi radial yang sesuai dari Li + ∙∙∙Li + , TFSI − ∙∙∙TFSI − , dan Li + ∙∙∙TFSI − di seluruh rentang konsentrasi (Gambar S8b , Informasi Pendukung). Osilasi asinkron dari distribusi ini dapat diartikan sebagai penyaringan timbal balik alternatif dari ion bermuatan berlawanan untuk membentuk netralitas muatan lokal.
Gambar 3
Buka di penampil gambar
Presentasi PowerPoint
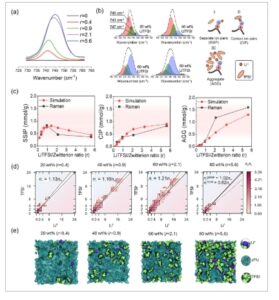
a) Evolusi konsentrasi intensitas dari pengukuran hamburan sinar-X sudut kecil zPU-SPE dibandingkan dengan hasil simulasi molekuler dari analisis faktor struktur sebagai fungsi vektor hamburan q . b) Evolusi konsentrasi Li + dan struktur solvasi zPU dalam zPU-SPE dijelaskan oleh fungsi distribusi radial ( g(r) , sumbu kiri), nomor koordinasi berjalan ( cn(r) , sumbu kanan) dari interaksi Li + ∙∙∙TFSI − , Li + ∙∙∙UR, dan Li + ∙∙∙zPU – . c) Evolusi konsentrasi lingkungan koordinasi Li + diwakili oleh distribusi statistik pusat interaksi negatif TFSI dan zPU (atom oksigen dari uretan (UR) dan karboksibetain (zPU − ) grup, berturut-turut) yang diperoleh melalui simulasi MD dari 20 (r = 0,4) hingga 80 wt.% (r = 5,6) LiTFSI. Data untuk rentang konsentrasi LiTFSI penuh (20–90 wt.% LiTFSI) ditunjukkan pada Gambar S10 . Perhatikan bahwa distribusi persentase <4% telah digabungkan dan diberi label sebagai TFSI i − UR j zPU k − . Konfigurasi yang paling mungkin diperoleh dari lintasan MD, dengan lingkaran putus-putus menunjukkan batas cangkang solvasi (ambang batas 3,25 Å) yang digunakan untuk analisis. Untuk memahami struktur solvasi garam Li dan polimer zPU dan efeknya pada konduktivitas ionik, distribusi radial dianalisis antara situs atom representatif dari semua konstituen zPU-SPE (Gambar 3b ). Pemeriksaan tepat interaksi interionik Li + ⋯TFSI − , yang dicirikan oleh atom oksigen sebagai pusat interaksi terkuat dalam TFSI − , menunjukkan puncak tajam pada ≈0,20 nm dengan minimum pada 0,26 nm. Ini menunjukkan interaksi interionik yang relatif kuat, yang khas untuk elektrolit organik cair, cairan ionik, dan SPE yang mengandung garam Li dengan anion triflimidat. Li + juga menunjukkan solvasi kompetitif oleh zPU, terutama terbukti untuk pasangan Li + ⋯O yang melibatkan gugus uretana (UR) dan karboksibetain (zPU − ). Puncak pertama untuk Li + ⋯zPU − (0,18 nm) dan Li + ⋯UR (0,19 nm) terjadi pada jarak yang sedikit lebih pendek daripada untuk Li + ⋯TFSI − , yang menunjukkan preferensi yang lebih kuat untuk lokalisasi Li + ke arah zPU − . Perpanjangan kulit solvasi lebih berbeda untuk pasangan ini daripada untuk kekuatan interaksinya. Minimum dalam distribusi radial untuk zPU − berada pada 0,25 nm, sedangkan untuk UR, berada pada 0,28 nm, yang dikaitkan dengan elektronegativitas yang lebih tinggi pada zPU − , didorong oleh sifat ZI dan momen dipol yang besar. Untuk mempelajari peran atom nitrogen dari gugus karboksibetain (zPU + ) sebagai daerah dengan kerapatan elektron yang lebih rendah, penyelidikan lebih lanjut terhadap solvasi TFSI − dan interaksi antar rantai dilakukan (Gambar S9 , Informasi Pendukung). Tidak seperti interaksi Li + , probabilitas radial dengan zPU + sebagai pusat referensi menunjukkan perilaku yang relatif kompleks, ditandai dengan beberapa puncak dengan intensitas yang jauh lebih rendah dan rentang yang lebih luas. Intensitas puncak terendah ≈0,3 nm untuk TFSI− menunjukkan interaksi terdelokalisasi yang lemah dengan zPU + . Puncak kedua pada 0,46 nm menunjukkan kedekatan dengan gugus sulfonil kedua. Interaksi antarrantai zPU lebih lemah (0,27–0,28 nm) karena persaingan antara asosiasi antarrantai dan solvasi Li + . Dispersi kerapatan elektron ini dapat menyebabkan interaksi yang relatif lemah dengan UR dibandingkan dengan zPU− . Perubahan dalam konten LiTFSI menyebabkan variasi dalam posisi, intensitas, dan bentuk distribusi radial yang menggambarkan interaksi antara konstituen elektrolit, tercermin dalam perubahan nomor koordinasi berjalan, c𝑛(𝑟), yang menandakan kemampuan koordinasi atom referensi sehubungan dengan yang diamati, dihitung dengan mengintegrasikan distribusi hingga minimum pertama ( sumbu y kanan Gambar 3b ). Peningkatan yang nyata dalam intensitas puncak cn(r) untuk Li + ⋯TFSI− dari 20 hingga 40 wt.% LiTFSI menunjukkan kenaikan cn(r) untuk TFSI − dari 0,35 hingga 1,36, yang selanjutnya meningkat menjadi 3,07 pada 80 wt.% dan 3,47 pada 90 wt.% LiTFSI. Namun, kemampuan koordinasi Li + dengan zPU (UR dan zPU − ) menurun dari 2,48 (Li + ⋯zPU − ) dan 0,91 (Li + ⋯UR) menjadi 0,56 dan 0,17, masing-masing, saat LiTFSI meningkat. Khususnya, pengurangan koordinasi Li + ⋯UR tetap stabil hingga 60 wt.% LiTFSI, kemudian menurun drastis saat konsentrasi LiTFSI meningkat. Tren ini menyoroti persaingan antara agregasi ion dan solvasi dengan meningkatnya kandungan garam. Saat konsentrasi garam Li meningkat, agregat menjadi lebih saling berhubungan, yang mendorong difusi Li + di sepanjang permukaan agregat anion. [ 42 ] Ini menunjukkan mekanisme transpor ion yang ditingkatkan dari zPU-SPE, yang secara efisien dapat memisahkan gerakan ion logam dari dinamika polimer. Sebaliknya, intensitas puncak pertama untuk zPU + menunjukkan koordinasi yang lemah dengan bagian TFSI − atau zPU − . Untuk menyelidiki lebih lanjut peran Li + dan zPU + sebagai pusat koordinasi utama dalam zPU-SPE, analisis statistik lingkungan koordinasi mereka dilakukan (lihat Gambar 3c ; Gambar S10 , Informasi Pendukung untuk lingkungan solvasi Li + dan Gambar S11 , Informasi Pendukung untuk zPU + ). Secara khusus, untuk lingkungan lokal Li + pada 20 wt.% LiTFSI (r = 0,4), dua kontribusi dominan diamati: Li + -zPU3− ( 27,4 %) dan Li + -UR-zPU2− ( 24,4 %), sedangkan keberadaan kompleks Li + -TFSI− kurang dari 4%, yang menunjukkan bahwa Li + lebih banyak berinteraksi dengan polimer daripada dengan TFSI− . Ketika LiTFSI meningkat hingga 40–60 wt.% (r = 0,9–2,1), redistribusi Li + terjadi, dengan kompleks ionik dan Li- zPU hidup berdampingan akibat penurunan bertahap Li + -zPU 3− dan Li + -UR-zPU 2− yang menguntungkan Li + TFSI i− ( i = 1–3), yang meningkat secara signifikan melampaui 60 wt.% (r = 2,1) kandungan LiTFSI. Transisi redistribusi Li + pada r = 0,9 – 2,1 yang diamati dalam analisis statistik juga dibuktikan oleh spektroskopi Raman. Gambar 4a-c menunjukkan analisis puncak Raman dari anion TFSI− dalam zPU-SPE dengan pemuatan LiTFSI yang berbeda. Saat konsentrasi LiTFSI meningkat, puncak bergeser ke bilangan gelombang yang lebih tinggi, yang menunjukkan koordinasi yang lebih besar antara TFSI− dan Li + (Gambar 4a ). [ 43 ] Setelah pemasangan puncak Raman, ion garam Li dapat dikategorikan menjadi pasangan ion yang dipisahkan pelarut (SSIP), pasangan ion kontak (CIP), dan agregat (AGG), seperti yang diilustrasikan dalam Gambar 4b . Pada r = 0,9–2,1, jumlah TFSI− dalam SSIP meningkat menjadi 0,76 mmol per gram zPU-SPE dengan peningkatan rasio LiTFSI/ZI dari r = 0,2 menjadi r = 1 (Gambar 4c ). Ketika rasio mol LiTFSI/ZI melebihi r = 1, jumlah TFSI − dalam SSIP turun karena saturasi ZI oleh ion garam. Disertai dengan penurunan jumlah SSIP, jumlah TFSI − dalam CIP dan AGG meningkat dan mendominasi pada konsentrasi garam yang lebih tinggi, yang konsisten dengan hasil simulasi MD dan analisis SAXS, yang mengakibatkan peningkatan mobilitas Li + dan, karenanya, konduktivitas ionik. Perlu dicatat juga bahwa, dengan redistribusi lingkungan koordinasi Li + ini , kontribusi diamati untuk Li + bebas , tidak terkait dengan anion atau polimer. Analisis tambahan zPU + sebagai pusat koordinasi menunjukkan dominasi yang jelas dari kompleks zPU + -zPU − (67,9%), yang secara bertahap menurun dengan meningkatnya konten LiTFSI. Tren serupa diamati untuk kompleks zPU + -UR yang kurang menonjol . Redistribusi koordinasi ini disertai dengan meningkatnya jumlah ion TFSI − di dekat zPU + . Hasil simulasi MD ini, bersama dengan analisis Raman dan peningkatan intensitas puncak SAXS pertama, menunjukkan adanya persaingan antara solvasi Li + , yang dominan hingga 40–60 wt.% dari LiTFSI, dan agregasi ion pada konsentrasi yang lebih tinggi (>60 wt.%). Akibatnya, difusi Li + di sepanjang permukaan agregat anion, serta pelepasan Li + bebas (>40 wt.%), yang tidak terkait dengan agregat ionik atau solvasi zPU, berkontribusi pada peningkatan signifikan konduktivitas ionik zPU-SPE.
Gambar 4
Buka di penampil gambar
Presentasi PowerPoint
a) Spektrum Raman zPU-SPE dengan rasio molar LiTFSI/ZI yang berbeda. b) Pencocokan puncak kurva Raman zPU-SPE dengan 20 (r = 0,4), 40 (r = 0,9), 60 (r = 2,1), dan 80 wt.% (r = 5,6) LiTFSI dan ilustrasi pasangan ion yang dipisahkan oleh pelarut (SSIP), pasangan ion kontak (CIP), dan agregat (AGG). c) Jumlah mol TFSI- dalam SSIP, CIP, dan AGG per gram zPU-SPE. d) Analisis populasi gugus ion TFSI – terhadap Li + untuk 20, 40, 60, dan 80 wt.% LiTFSI dalam zPU-SPE yang direpresentasikan dalam skala logaritmik. Batang vertikal menggambarkan frekuensi kemunculan kluster terkait yang dianalisis berdasarkan jarak ambang 3,75 Å antara atom Li dan N, O, dan F dari TFSI – . Garis diagonal hitam menggambarkan kenetralan agregat ion, dan garis merah yang dipasang pada polinomial derajat pertama n – = an + (di mana a adalah koefisien pemasangan), menggambarkan deviasi dari kenetralan ke arah agregat kaya ion negatif ( a > 1) atau positif ( a < 1). e) Visualisasi distribusi ion dalam matriks zPU dengan irisan snapshot representatif sepanjang sumbu Z sel MD yang diseimbangkan. Snapshot untuk rentang konsentrasi LiTFSI penuh (20–90 wt.% LiTFSI) ditunjukkan pada Gambar S12 (Informasi Pendukung). Telah ditetapkan dengan baik bahwa disosiasi garam yang lebih baik terjadi dengan interaksi pelarut-garam yang lebih kuat dan interaksi kation-anion yang lebih lemah. [ 44 ] Dalam elektrolit polimer tradisional, disosiasi tersebut biasanya dicapai oleh polimer dengan gugus khelasi ion, seperti gugus eteral. [ 11 ] Transpor ionik melintasi elektrolit polimer dapat terjadi melalui mekanisme kendaraan atau struktural. [ 45 ] Dalam mekanisme kendaraan, ion bergerak dengan segmen rantai polimer, sedangkan dalam mekanisme struktural, ion melompat melalui proses asosiasi-disosiasi ion serial atau transpor dalam gugus ion. Pada pemuatan garam rendah (wilayah SIP), khelasi kuat Li + oleh segmen rantai membuat transpor Li + hampir secara eksklusif kendaraan. ZIs menunjukkan efek khelasi yang lebih kuat dengan ion logam, sebagaimana dibuktikan oleh jarak puncak yang lebih kecil dan probabilitas yang lebih besar dalam distribusi radikal, sehingga meningkatkan disosiasi garam Li. Pengaruh ZIs dalam meningkatkan konduktivitas ionik telah diamati dalam berbagai elektrolit PIS, di mana peningkatan transpor ion dikaitkan dengan disosiasi yang lebih baik dan jumlah ion pembawa yang lebih tinggi. [ 16 , 46 ] Konduktivitas ionik meningkat dengan meningkatnya pemuatan garam dalam zPU-SPE, sebuah fenomena yang juga diamati dalam polimer tradisional yang digunakan untuk menyiapkan elektrolit PIS. [ 11 , 12 , 35 , 47 ] Dalam elektrolit PIS tradisional ini, konduktivitas ionik meningkat hingga fase kristal lokal terbentuk, biasanya rasio mol garam Li terhadap unit pengulangan polimer kurang dari 2,0, dan nilai konduktivitas ionnya pada suhu kamar adalah ≈10 −6 S/cm. [ 47 , 48 ] Mekanisme di balik peningkatan konduktivitas ini belum sepenuhnya dipahami sejauh ini. [ 44 ] Dalam elektrolit PIS, jumlah molekul solvasi tidak cukup untuk mengoordinasikan semua kation sepenuhnya dan memisahkannya dari anion. Akibatnya, transpor kation terjadi melalui pertukaran anion dan pelarut atau difusi kluster bermuatan, karena hanya sebagian kecil Li + yang dipisahkan oleh pelarut. [ 44 ] Kompetisi solvasi serupa ditemukan di zPU-SPE melalui simulasi dan studi Raman yang dibahas sebelumnya. Namun, tidak seperti elektrolit polimer tradisional, zPU-SPE menunjukkan peningkatan konduktivitas ionik hingga 90 wt.% dari LiTFSI (r = 12,6) tanpa kristalisasi. Kapasitas pemuatan garam yang tinggi ini disebabkan oleh kemampuan solvasi yang kuat dari gugus ZI terhadap kation dan anion. Selain itu, di wilayah PIS (pemuatan garam >50 wt.%), konduktivitas keseluruhan zPU-SPE pada suhu ruangan adalah 1–2 kali lipat lebih tinggi daripada elektrolit tradisional.
Analisis pembentukan gugus ion selanjutnya dapat menjelaskan hubungan antara konduktivitas ion dan pembentukan agregat ion pada konsentrasi garam tinggi, yang dapat dianggap sebagai mekanisme dominan untuk variasi komposisi zPU-SPE. Analisis populasi pembentukan gugus ion dilakukan pada berbagai konsentrasi LiTFSI (Gambar 4d ), dengan distribusi ion dalam zPU-SPE divisualisasikan melalui snapshot representatif (Gambar 4e ). Meskipun ada perbedaan dalam perluasan spasial dengan konten LiTFSI yang bervariasi, fitur utama di semua distribusi adalah probabilitas yang relatif tinggi dari pembentukan pasangan ion dan keberadaan ion Li + dan TFSI − bebas . Pada konsentrasi rendah, ion Li + terlarut (≈73%) mendominasi anion terlarut (<0,5%), pasangan netral (20%), dan agregat yang lebih besar (2%). Saat konten LiTFSI meningkat, probabilitas agregat ini sedikit meningkat. Asosiasi ion menyebabkan agregat ion bermuatan negatif yang awalnya tinggi meluas secara spasial, menggeser keseimbangan muatan ke arah gugus netral. Menariknya, pada konten LiTFSI tertinggi, distribusi menyusut menjadi kluster yang lebih kecil. Saat zPU-SPE jenuh dengan LiTFSI, domain kluster meluas, membentuk agregat ion bermuatan positif yang bercabang. Hal ini berpotensi menunjukkan pembentukan kluster bermuatan positif berukuran terbatas daripada aglomerasi LiTFSI besar dalam matriks zPU, konsisten dengan hasil SAXS dan SEM-EDX. Hasil analisis populasi kluster ion sangat menyarankan bahwa pengelompokan ion unik dalam zPU-SPE dengan komposisi garam Li tinggi (disebut elektrolit PIS) dapat menjadi mekanisme utama untuk konduktivitas ionik tinggi yang melekat. Fitur umum pengelompokan ion adalah peningkatan luas spasial dengan konten LiTFSI. Seiring dengan pembentukan agregat orde lebih tinggi ( n + n − > 18), kontribusi utama berasal dari pasangan Li + bebas dan netral. Pada pemuatan LiTFSI rendah, fenomena ini disebabkan oleh solvasi Li + yang lebih tinggi oleh UR dan zPU − . Namun, saat LiTFSI lebih lanjut meningkat, pengurangan Li + bebas dijelaskan oleh asosiasi ion yang dominan. Pergeseran dari netralitas dalam agregat ion menuju kluster bermuatan negatif disebabkan oleh konten TFSI − yang lebih tinggi , yang berkurang saat anion disolvasi oleh zPU + . Hal ini menyebabkan peningkatan mobilitas Li + dan, karenanya, peningkatan konduktivitas ionik.
2.4 Karakterisasi Kinerja Sel Baterai dengan zPU-SPE
Deposisi dan stripping Li yang tidak seragam selama siklus ASSLB dapat menyebabkan pembentukan lapisan antarmuka elektrolit padat (SEI) yang tidak stabil dan pertumbuhan dendrit Li, yang selanjutnya dapat memicu reaksi samping yang tidak diinginkan dan pengurangan efisiensi Coulombik (CE). Untuk menyelidiki kompatibilitas zPU-SPE dengan anoda Li dan memeriksa perilaku stripping/pelapisan, kami mendaur ulang sel simetris Li-Li selama 200 jam dengan kepadatan arus yang meningkat. Seperti yang ditunjukkan pada Gambar 5a , kurva tegangan-waktu menunjukkan bahwa zPU-SPE tetap stabil di bawah setiap kepadatan arus, dan stabilitas jangka panjangnya yang sangat baik ditunjukkan lebih lanjut pada Gambar S13 (Informasi Pendukung). Bentuk ‘lengkungan’ khas di tepi profil tegangan, yang umum diamati pada SPE yang menunjukkan akumulasi Li dendritik dan mati, [ 49 ] tidak muncul untuk zPU-SPE (Gambar 5b ). Sebagai perbandingan, sel simetris Li-Li dengan PEO-SPE tradisional tidak dapat didaur ulang pada suhu ruangan karena polarisasi yang besar bahkan pada kerapatan arus yang rendah. Bahkan pada suhu tinggi 60 °C, sel dengan PEO-LiTFSI hanya dapat didaur ulang pada kerapatan arus yang rendah dan mengalami korsleting pada 0,2 mA cm −2 (Gambar S14 , Informasi Pendukung). Kinerja zPU-SPE yang unggul dibandingkan dengan PEO-SPE dapat dikaitkan dengan kompatibilitas yang baik dan kontak antarmuka antara elektroda zPU-SPE dan Li, karena energi adhesi zPU-SPE yang tinggi, yang secara substansial mengurangi resistansi antarmuka dan menghasilkan fluks Li + yang seragam .
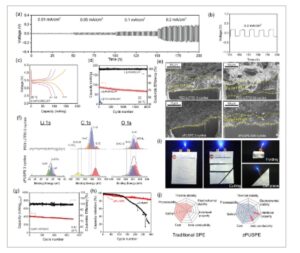
Gambar 5
Buka di penampil gambar
Presentasi PowerPoint
a) Daur ulang pelat-strip zPU-SPE dalam sel simetris litium. Hasil siklus yang diperluas ditunjukkan pada Gambar S14 (Informasi Pendukung). b) Gambar yang diperbesar dari siklus pelat-strip di bawah 0,2 mA cm −2 . c) Profil pengisian/pengosongan sel koin Li||zPU-SPE||LiFePO 4 pada berbagai laju C. d) Kapasitas pengosongan dan efisiensi coulombik versus jumlah siklus yang diukur untuk sel koin Li||zPU-SPE||LiFePO 4 pada laju 1C dan 20 °C. e) Gambar PFIB-SEM dari permukaan litium setelah daur ulang dalam sel koin Li/zPU-SPE/LiFePO 4 dan sel koin Li||PEO-LiTFSI||LiFePO 4. f) Karakterisasi komponen lapisan SEI pada anoda logam litium yang didaur ulang oleh XPS. g) Profil pengisian/pengosongan sel koin Li||zPU-GPE||S/C pada 0,3C. h) Kurva retensi kapasitas sel koin Li/S dengan Celgard 2500 dan zPU-GPE pada laju 0,3C. i) Eksperimen pembengkokan, pemotongan, dan penusukan sel kantong lunak Li||zPU-SPE||LiFePO4 . j) Peta radar untuk perbandingan zPU-SPE dengan SPE tradisional.
Gambar 5c menunjukkan profil pengisian-pengosongan pada laju C yang berbeda. Pada laju C/10, C/2, dan C/1, sel dengan zPU-SPE menunjukkan kapasitas pengosongan masing-masing sebesar 148,2, 105, dan 87,5 mAh/g. Pada laju C tinggi sebesar 1C, zPU-SPE mempertahankan 59% dari kapasitas yang dicapai pada laju C/10, yang sebanding dengan elektrolit polimer yang dilaporkan sebelumnya. Karena energi aktivasi konduktivitas ionik yang rendah dalam plot Arrhenius, zPU-SPE dapat mempertahankan sifat transpor ion yang tinggi pada suhu sekitar. Kinerja siklus dan kemampuan laju zPU-SPE dievaluasi pada 20 °C dalam sel koin yang terdiri dari katode LFP dan anoda Li (Gambar 5d ). Sel tersebut didaur ulang pada laju pengisian-pengosongan 1C dan mencapai kapasitas stabil sebesar ≈87,5 mAh/g pada awal siklus. Setelah 1000 siklus, zPU-SPE menunjukkan kapasitas pelepasan 73,2 mAh/g dengan retensi kapasitas 83,7%. Bahkan setelah 2000 siklus, sel masih dapat mempertahankan kapasitas 53,2 mAh/g dengan retensi kapasitas 76,1%. Sebaliknya, kapasitas sel dengan PEO-SPE menurun cepat hingga 30% dari kapasitas awalnya dan gagal setelah 100 siklus. Meskipun berbagai SPE untuk ASSLB telah dikembangkan dalam beberapa tahun terakhir, data siklus yang dilaporkan dari sel-sel ini biasanya terbatas pada 500 siklus, seringkali hanya 100 siklus. Namun, LIB berkinerja tinggi yang diinginkan harus menunjukkan setidaknya 1000 siklus masa pakai siklus dengan retensi kapasitas 80%. [ 50 ] Dengan memanfaatkan sifat transpor ion yang baik dan karakteristik stabilitas antarmuka, zPU-SPE mencapai masa pakai siklus dengan retensi kapasitas 80% sebanyak 1670 siklus. Selain itu, karena energi aktivasinya rendah untuk konduktivitas ionik (seperti yang ditunjukkan dalam plot Arrhenius pada Gambar 2f ), zPU-SPE dapat mempertahankan 87% kapasitas spesifik pada suhu 0 °C (Gambar S15 , Informasi Pendukung), peningkatan substansial dibandingkan sebagian besar LIB, yang biasanya menunjukkan retensi kapasitas kurang dari 80%.
Siklus stabil ASSLB dengan zPU-SPE dipelajari lebih lanjut dengan memeriksa morfologi Li setelah siklus. Seperti yang ditunjukkan dalam analisis FIB-SEM (focused ion beam-SEM) pada Gambar 5e , setelah tiga siklus pengkondisian pada suhu 0,1C, Li yang disikluskan dengan elektrolit PEO-LiTFSI menunjukkan pelat Li berbentuk bulat dengan ketebalan total 9,3 µm. Sebaliknya, zPU-SPE menghasilkan endapan Li halus dengan ketebalan tipis kurang dari 1 µm. Setelah 50 siklus tambahan pada suhu 1C, lapisan Li dengan elektrolit PEO-LiTFSI mengembangkan struktur berpori, dengan rongga besar baik pada antarmuka Li/substrat maupun dalam struktur massal Li yang diendapkan, menghasilkan ketebalan total 9,6 ± 2,4 µm. Sebaliknya, bahkan setelah 800 siklus pada 1C, zPU-SPE menunjukkan permukaan yang halus dan bebas dendrit dengan partikel Li berbentuk bulat dan padat serta ketebalan 6,01 ± 1,1 µm. Porositas rendah dan ketebalan yang berkurang yang dihasilkan dengan zPU-SPE berkontribusi pada integritas struktural yang sangat baik, peningkatan CE, perubahan volume yang diminimalkan, dan polarisasi yang berkurang selama siklus jangka panjang, yang sebagian menjelaskan stabilitas siklus ASSLB yang luar biasa dengan zPU-SPE.
Analisis XPS digunakan untuk mempelajari lebih lanjut komposisi lapisan SEI pada Li yang didaur ulang. Seperti yang ditunjukkan pada Gambar 5f , setelah tiga siklus pembentukan dengan PEO-LiTFSI di bawah C/10, permukaan Li kaya akan senyawa organik berbasis karbon dengan hampir tidak ada komponen anorganik. Sebagai perbandingan, setelah tiga siklus pembentukan di bawah laju C yang sama dengan zPU-SPE, spesies anorganik seperti Li x N, Li 2 CO 3 , dan LiF hadir. Lapisan SEI yang lebih anorganik di zPU-SPE dapat dikaitkan dengan pemuatan garam anorganik yang jauh lebih tinggi (r = 5,6, 80 wt.% LiTFSI) dibandingkan dengan PEO-LiTFSI (30 wt.% LiTFSI). Senyawa Li anorganik memiliki energi antarmuka yang lebih tinggi dengan logam Li, yang dapat meningkatkan difusi Li + melalui antarmuka SEI/Li dan menekan penetrasi dendrit logam Li melalui lapisan SEI. [ 51 ] Selain itu, lapisan SEI anorganik memiliki modulus yang lebih tinggi daripada lapisan SEI organik, sehingga secara mekanis lebih kuat untuk mencegah pertumbuhan dendrit Li. [ 52 ] Dengan demikian, lapisan SEI anorganik dari zPU-SPE berkontribusi pada siklus yang lebih stabil dan waktu hidup yang lebih lama dalam sel ASSLB.
Untuk menilai kinerja elektrokimia zPU-SPE di luar ASSLB dengan katode LFP, baterai litium-sulfur (Li/S) dengan elektrolit polimer gel zPU (zPU-GPE) dirakit, dan siklus pengisian dan pengosongan galvanostatiknya dilakukan pada 0,3C dan 20 °C. Seperti yang ditunjukkan pada Gambar S16 (Informasi Pendukung), profil pengosongan tipikal mirip dengan sel Li/S yang dirakit dengan elektrolit cair dan pemisah Celgard 2500 (Gambar S17a , Informasi Pendukung). Kurva pengosongan menunjukkan dua plateau pada 2,26 dan 2,08 V. Dengan peningkatan jumlah siklus, kedua plateau ini terpelihara dengan baik dan tetap ada bahkan setelah 300 siklus. Meskipun kapasitas pelepasan sel Li/S dengan zPU-GPE pada siklus pertama (415 mAh/g) lebih rendah daripada sel Li/S cair dengan Celgard (854 mAh/g), mungkin karena resistansi membran yang lebih tinggi, kapasitas sel zPU-GPE hanya sedikit berkurang menjadi 350 mAh/g pada siklus ke-300. Selain itu, sel Li/S dengan zPU-GPE mempertahankan CE yang tinggi (mendekati 100%). Sebagai perbandingan, kapasitas sel Li/S cair dengan pemisah Celgard menurun lebih cepat daripada sel zPU-GPE, sebagaimana dibuktikan oleh kurva pengisian-pengosongan untuk nomor siklus yang berbeda (Gambar S17b , Informasi Pendukung). Akhirnya, sel Li/S cair gagal setelah 300 siklus. Seperti yang ditunjukkan pada kurva retensi pelepasan pada Gambar 5h , meskipun kapasitas awal sel Li/S dengan zPU-GPE lebih rendah, laju peluruhannya jauh lebih rendah daripada Celgard 2500, sebagian besar disebabkan oleh kemampuan membran zPU yang sangat baik untuk menekan perpindahan polisulfida. Khususnya, setelah kapasitas sel Li/S dengan zPU-GPE stabil pada 130 siklus, kapasitasnya hanya berkurang 1,3% selama 170 siklus berikutnya (0,07 mAh/g dan peluruhan 0,019% per siklus), dan retensi kapasitasnya adalah 85% pada 300 siklus.
Sel kantong kemasan lunak dibuat untuk mengeksplorasi aplikasi zPU-SPE dan menilai keamanannya. Keamanan sel kantong Li||zPU-SPE||LiFePO 4 ditunjukkan pada suhu ruangan dalam beberapa kondisi yang merusak, seperti yang ditunjukkan pada Gambar 5i . Tidak terjadi hubungan arus pendek bahkan setelah sel kantong dipotong atau ditusuk. Khususnya, setelah tiga kali pemotongan dan tiga kali penusukan, sebagian kecil dari sel kantong yang tersisa terus menyalakan perangkat LED, yang menunjukkan bahwa keandalan dan keamanan sel kantong zPU-SPE terjaga secara efektif.
Gambar 5j menunjukkan peta radar yang membandingkan kinerja zPU-SPE dengan SPE konvensional (perbandingan dengan IE ditunjukkan pada Gambar S18 , Informasi Pendukung). ASSLB telah menarik minat yang signifikan karena manfaat keamanannya. Selama dekade terakhir, kemajuan substansial telah dibuat dalam studi bahan elektrolit di ASSLB. Namun, beberapa tantangan masih tetap ada. Meskipun IE menawarkan konduktivitas Li + yang sangat baik , selektivitas kation yang tinggi (yaitu, jumlah transferensi), stabilitas elektrokimia dan termal yang unggul, dan kemampuan untuk membatasi penetrasi dendrit, penggunaannya yang luas di LIB dibatasi oleh kerapuhannya, serta kompatibilitas antarmuka yang buruk dengan elektroda. [ 3 ] Sebaliknya, SPE memberikan fleksibilitas yang ditingkatkan dan kemudahan pemrosesan tetapi secara intrinsik memiliki konduktivitas ionik suhu kamar yang rendah, seperti yang ditunjukkan pada Gambar 5j . zPU-SPE menggabungkan keunggulan SPE dan IE tradisional, sekaligus meningkatkan sifat antarmuka dan fungsi penyembuhan mandiri dengan menggabungkan segmen ZI ke dalam tulang punggung PU. Dengan demikian, menggabungkan grup ZI menawarkan pendekatan yang menjanjikan untuk mengembangkan SPE generasi berikutnya guna memenuhi tuntutan LIB berkinerja tinggi.
3 Kesimpulan
Singkatnya, kami memperkenalkan zPU-SPE multifungsi yang mengatasi keterbatasan bahan SPE konvensional untuk ASSLB. Kami menunjukkan kemampuan zPU-SPE untuk menampung 80 wt.% LiTFSI (r = 5,6) tanpa pemisahan fase. Konduktivitas ionik zPU-SPE pada 25 °C adalah 7,4 × 10 −4 S cm −1 dengan t Li+ 0,44 , yang melanggar batasan trade-off selektivitas dan konduktivitas Li + . Energi permukaan zPU-SPE yang tinggi (338,4 vs. 60,5 J m −2 PEO) secara efektif dapat meminimalkan resistansi antarmuka, dan elastisitasnya yang luar biasa serta sifat penyembuhan sendiri dikaitkan dengan interaksi dipol-dipol dan ikatan hidrogen antar dan intramolekul yang padat. Kinerja baterai ASSLB didemonstrasikan menggunakan sel Li||SPE||LiFePO4 yang didaur ulang pada suhu 1C dan 25 °C. Sel ASSLB dengan zPU-SPE menunjukkan stabilitas siklus yang luar biasa, mempertahankan 86% kapasitasnya setelah 1000 siklus dan 76% setelah 2000 siklus dengan katode LiFePO₄. Lebih jauh lagi, sel Li/S yang dirakit dengan zPU-GPE mencapai retensi kapasitas 85% setelah 300 siklus, semuanya dengan ≈100% CE. Kami juga melakukan pemodelan molekuler atomistik dan SAXS untuk menyelidiki pelarutan garam Li, disosiasi, mekanisme transpor Li + , dan organisasi struktural matriks zPU-SPE. Kinerja elektrokimia zPU-SPE yang sangat baik dapat dikaitkan dengan kompatibilitasnya yang baik dengan elektroda, resistansi transfer muatan yang rendah pada antarmuka elektroda/elektrolit, dan konduktivitas Li + yang tinggi , yang secara kuat menunjukkan bahwa zPU-SPE adalah kandidat potensial untuk pengembangan SLB berkinerja tinggi.
4 Bagian Eksperimen
Bahan
Dietanolamina (99%), polietilena oksida (PEO; M w = 600.000), poli(vinilidena fluorida) (PVDF; M w = 534.000), dan metanol (CH 3 OH; ≥98%), digunakan sebagaimana yang diterima dari Sigma–Aldrich (Missouri, AS). 1,6 Diisocyanatoheksana (HDI; ≥99%), etil akrilat (99,5%), dietil eter (>95%), dan dimetilformamida tingkat ekstra kering (DMF; 99,8%) diperoleh dari Acros Organics (Pittsburg, AS). Garam bis(trifluoromethane) sulfonimide litium (LiTFSI; 99,95%) dibeli dari Sigma–Aldrich (St. Louis; Missouri, AS) dan disimpan dalam glovebox berisi Ar dengan <0,1 ppm H 2 O. Pelarut 1,3-Dioxolane (DOL; 99,5%), dan 1,2-Dimethoxy ethane (DME; ≥99%) diterima dari Fisher Scientific (Ottawa, Kanada) dan selanjutnya dikeringkan di atas saringan molekuler 3Å yang diaktifkan (adsorben Delta; Illinois, AS). Cu berlapis Li (ketebalan 53 µm), dan LiFePO 4 (LFP, ukuran partikel granular D(50): 1,5 µm) dibeli dari MSE (Arizona, AS).
Pembuatan zPU-SPE
zPU [poli((dietanolamin etil asetat)-ko-(1,6-diisocyanatoheksana))] disintesis berdasarkan metode yang dilaporkan sebelumnya. [ 53 ] Secara singkat, prekursor ZI dan pemanjang rantai diol, dietanolamin etil asetat (DEAEA), disintesis dengan rasio 1:1,1 dietanolamin (Sigma–Aldrich, AS) dan etil akrilat (Acros Organics, AS). zPU disintesis melalui reaksi satu pot dengan rasio 1:1 DEAEA:1,6-diisocyanathoheksana (Acros Organics, AS), diikuti oleh pendinginan CH 3 OH (Sigma–Aldrich, AS) dan pemurnian dalam dietil eter (Acros Organics, AS). Larutan zPU yang dimurnikan dicetak dalam cawan PTFE dan dikeringkan dalam oven vakum pada suhu 100 °C untuk menghilangkan sisa pelarut. Setelah pengeringan, film zPU pipih dikupas dari cawan PTFE. Film tipis zPU yang telah disiapkan dihidrolisis dalam air deionisasi (DI) selama 2 hari untuk menghasilkan gugus karboksibetain ZI, diikuti dengan pengeringan selama 18 jam dalam oven vakum pada suhu 100 °C untuk menghilangkan sisa air. zPU-SPE disiapkan dalam kotak sarung tangan berisi Ar dengan konsentrasi air di bawah 0,1 ppm. Film tipis zPU yang telah dihidrolisis diimpregnasi dengan larutan elektrolit yang terdiri dari LiTFSI (Sigma–Aldrich, AS) dalam campuran 1:1 vol% pelarut 1,3-dioksolana (DOL) dan 1,2-dimetoksietana (DME) (Fisher Scientific, Kanada). Setelah 18 jam penyeimbangan, film zPU yang telah disiapkan dikeringkan dalam oven vakum pada suhu 80 °C selama 18 jam untuk menghilangkan DOL/DME, sehingga menghasilkan elektrolit film zPU-SPE yang tipis. Rasio LiTFSI/zPU adalah 5,6 kecuali disebutkan secara khusus.
Untuk pembuatan zPU-GPE, larutan zPU 4wt.% dalam DMF diinfiltrasikan secara homogen ke dalam penyangga membran polietilena (PE) mikropori dengan ketebalan 16 µm dan porositas 80%. Infiltrasi dilakukan dalam vakum pada suhu kamar selama 6 jam. Selanjutnya, membran dikeringkan dalam oven konvensional pada suhu 50 °C selama 5 jam, diikuti dengan pengeringan lebih lanjut dalam oven vakum pada suhu 80 °C selama 18 jam. Membran zPU yang diperkuat mengalami hidrolisis dalam air DI selama 2 hari, diikuti dengan pengeringan dalam oven vakum pada suhu 80 °C selama 24 jam. Membran zPU yang terhidrolisis direndam dalam 1M LiTFSI + 3 wt.% LiNO 3 dalam larutan elektrolit DOL-DME (1:1 v/v) selama 18 jam. Elektrolit cair berlebih dihilangkan menggunakan Kimwipes untuk memperoleh zPU-GPE dengan ketebalan sekitar 17 µm.
Karakterisasi Fisikokimia
Mikroskopi elektron pemindaian dan spektroskopi sinar-X dispersif energi (SEM-EDS) (JSM-IT500HR FESEM, JEOL) dilakukan untuk mempelajari distribusi LiTFSI dalam zPU-SPE dan morfologi penampang komponen sel baterai. Stabilitas termal zPU-SPE diselidiki menggunakan analisis termogravimetri (TGA) (Pyris 1, PerkinElmer) dengan laju peningkatan suhu 5 °C min −1 . Komposisi kimia dan asosiasi garam-polimer antara LiTFSI dan zPU dievaluasi dengan menggunakan spektroskopi fotoelektron sinar-X (XPS) (AXIS-165, Kratos) dan spektroskopi inframerah transformasi Fourier reflektansi total yang dilemahkan (ATR-FTIR) (Vertex 80, Bruker). Setiap pengukuran direkam dalam wilayah inframerah-tengah dengan resolusi 4 cm −1 . Percobaan tegangan tarik mekanis dan adhesi permukaan dilakukan menggunakan mesin uji bangku kompak (EZ-Test, Shimadzu) dengan kecepatan 1 mm s −1 . Energi adhesi permukaan dihitung menggunakan metode yang dilaporkan, [ 22 ] di mana sampel diapit di antara dua lembaran tembaga berlapis Li dan dikupas dengan penguji mekanis universal pada kecepatan 1 cm min −1 . Energi adhesi dihitung dari gaya pengelupasan per lebar sampel (Gambar S4 , Informasi Pendukung).
Pembuatan Baterai dan Karakterisasi Elektrokimia
Konduktivitas ionik diukur dengan Spektroskopi Impedansi Elektrokimia (EIS) dengan sel simetris baja tahan karat tipe Swagelok melalui potensiostat (Autolab, Metrohm). Intersep plot Nyquist dengan sumbu x digunakan sebagai resistansi untuk menghitung konduktivitas ionik. Untuk perhitungan nomor transferensi Li + (t Li+ ), diikuti metode oleh Bruce dan rekan kerja, menggunakan polarisasi DC yang dikombinasikan dengan spektroskopi impedansi dalam sel simetris litium pada tegangan terapan 20 mV. [ 54 ] Eksperimen voltametri sapuan linier (LSV) dilakukan pada laju pindai 1 mV s −1 , dengan litium sebagai elektroda lawan dan baja tahan karat sebagai elektroda kerja. Untuk uji pelepasan-pelapisan litium, sel litium simetris dirakit dengan foil tembaga sebagai pengumpul arus. Sel diisi dan dikosongkan pada kerapatan arus yang telah ditentukan untuk jangka waktu masing-masing 30 menit.
Pengujian sel LB dalam konfigurasi LFP||zPU-SPE||Li dilakukan menggunakan sel koin baja tahan karat CR2025 dan sel kantong 3450. Katoda LFP dibuat mengikuti protokol yang dilaporkan sebelumnya. [ 33 ] PVDF, yang digunakan sebagai pengikat, pertama-tama dilarutkan dalam NMP dan diaduk semalaman. Selanjutnya, partikel LFP, karbon konduktif, dan larutan PVDF-NMP (LFP:karbon:PVDF = 80:10:10 wt.%) digabungkan dan digiling dengan bola zirkonia untuk memastikan pencampuran yang homogen. Bubur yang dihasilkan kemudian dicetak ke aluminium foil, dikeringkan, dan dikalender sebelum digunakan.
Semua sel dirakit dalam glovebox berisi Ar dengan kadar air <0,1 ppm. Untuk sel koin, elektroda dan zPU-SPE dipotong menjadi cakram bundar dengan diameter masing-masing 3/8 inci dan 1/2 inci. Untuk sel kantong, katode, anoda tembaga berlapis Li, dan zPU-SPE dipotong masing-masing menjadi 34 mm × 50 mm, 36 mm × 52 mm, dan 40 mm × 55 mm. Pemuatan aktif katode LFP adalah 1,3 mg cm −2 . Katode diinfiltrasi dengan zPU-SPE sebagai katolit. Secara khusus, larutan zPU yang dimurnikan dituangkan ke katode LFP, yang memungkinkan larutan mengisi pori-pori katode. Setelah pengeringan vakum pada suhu 80 °C, katode yang diisi polimer zPU mengalami hidrolisis, impregnasi garam, dan pengeringan lebih lanjut, mengikuti proses fabrikasi zPU-SPE yang dijelaskan dalam Bagian Fabrikasi zPU-SPE . Anoda litium memiliki ketebalan 50 µm. Sel dikondisikan terlebih dahulu melalui tiga siklus pada laju C/20 sebelum pengujian siklus yang diperpanjang. Pengukuran siklus pengisian-pengosongan galvanostatik dilakukan menggunakan penganalisa baterai delapan saluran (CT-4008-5V10mA, Newware) pada suhu 20 °C. Pengujian pengisian dan pengosongan menggunakan tegangan batas masing-masing 4,1 V dan 2,5 V.
Untuk pembuatan sel koin Li||elektrolit||S/C, membran zPU yang diperkuat ditempatkan di antara anoda Li─Cu (MSE Supplies, AS) dan katoda S/C komersial (NexTech Batteries, AS). Membran Celgard 2500 yang jenuh dalam elektrolit cair digunakan sebagai kontrol. Untuk semua sel, katoda S/C dikeringkan dalam oven vakum pada suhu 60 °C selama 24 jam dan dibasahi terlebih dahulu dengan 15 µL larutan elektrolit 1 M LiTFSI + 3 wt.% LiNO₃ dalam DOL-DME (1:1 v/v). Muatan massa sulfur dalam katoda S/C adalah 3,25 mg cms − 2 . Semua sel dirakit dalam glovebox berisi argon (<0,1 ppm H₂O). Sel koin Li/S yang telah dirakit dikondisikan terlebih dahulu selama dua siklus pada laju 0,03C dan 0,06C, diikuti oleh siklus lanjutan pada 0,3C.
Simulasi Dinamika Molekuler
Untuk simulasi dinamika molekular (MD) klasik, sistem zPU-SPE yang menyusun garam LiTFSI dengan rasio LiTFSI/ZI 0,2–5,6 (20 – 90 wt.%) dirakit. OPLS(-AA) semua atom non-polarizable, “Optimized Potentials for Liquid Simulations,” medan gaya (sebagaimana tersedia dalam basis data paket simulasi Gromacs), [ 55 , 56 ] digunakan untuk menyesuaikan sebagian besar parameter potensial intra dan intermolekul, menggambarkan istilah kovalen dalam peregangan ikatan, tekukan sudut dan torsi sudut dihedral sepanjang ikatan kovalen, dan istilah non-kovalen yang direpresentasikan oleh van der Waals. Panjang rantai 20 monomer zPU dipilih. Setiap sistem awal dihasilkan oleh Packmol [ 57 ] dan ditempatkan ke dalam kotak ortorombik dengan kondisi batas periodik 3D. Semua simulasi MD dilakukan menggunakan Gromacs, v2016.3. Persamaan gerak diintegrasikan menggunakan algoritma leap-frog [ 58 ] dengan langkah waktu 2 × 10 −6 ns. Sistem zPU-SPE diminimalkan energinya menggunakan algoritma steepest descent, diikuti oleh protokol keseimbangan isotermal-isobarik dan kanonik bertahap yang sama yang dilaporkan untuk sistem SPE yang serupa [ 59 ] dengan menerapkan termostat dan barostat Berendsen, [ 60 ] dengan konstanta kopling 3 × 10 −4 dan 5 × 10 −4 ns untuk langkah awal, dan termostat penskalaan ulang kecepatan [ 61 ] dan barostat Parrinello-Rahman [ 62 ] untuk langkah terakhir. Selama tahap produksi, termostat digantikan oleh termostat Nose-Hoover (8 × 10 −4 ns). [ 63 ] Properti struktural yang disajikan dalam karya ini lebih ditingkatkan dengan kode Travis, [ 64 ] v052121.
Spektroskopi Raman
Sampel-sampel tersebut diletakkan di atas slide mikroskop dengan pita karbon di tepinya, dan slide kuarsa diletakkan dan direkatkan di atasnya untuk membuat konfigurasi sandwich. Pita Gorilla kemudian digunakan di tepi slide untuk memastikan sistem tertutup rapat. Mikroskop Raman confocal (NRS-5100, JASCO) memetakan susunan titik 3 × 3 untuk mengumpulkan setiap sampel untuk 9 wilayah yang berbeda. 5–9 spektrum kemudian diambil untuk setiap sampel dan dirata-ratakan, diikuti dengan pengurangan latar belakang spektrum kuarsa. Data dikumpulkan dengan laser 532 nm pada 5 akumulasi untuk paparan 10 detik per spektrum.
Karakterisasi Permukaan Litium
Elektroda logam Li diambil dari sel koin dan kemudian dicuci dengan DME untuk menghilangkan elektrolit polimer sisa dalam glovebox berisi Ar (H 2 O dan O 2 <0,1 ppm). XPS dilakukan dengan spektrometer fotoelektron sinar-X (XPS) (Kratos Axis Ultra, Shimadzu) dengan sumber anoda aluminium pada 10 kV dan ukuran titik 300 mm x 700 mm selama akuisisi. Tekanan ruang dijaga pada <10 −8 torr selama semua pengukuran. Pemasangan spektrum XPS diperoleh menggunakan perangkat lunak CasaXPS untuk menentukan spesies permukaan menggunakan latar belakang Shirley dan didasarkan pada ikatan C─C referensi pada 284,8 eV.
Untuk pengukuran PFIB-SEM, sampel dipasang pada potongan SEM Ted Pella dan ditempatkan dalam kantong aluminium yang disegel panas sebelum dipindahkan ke Plasma FIB-SEM (Helios G4, Thermo Scientific). Sinar ion Xenon dengan tegangan 30 kV dan arus sinar 200 nA digunakan untuk membuat penampang anoda logam Li. Penampang tersebut dipoles dengan arus sinar ion 60 nA. Gambar SEM dari penampang tersebut diambil menggunakan detektor lensa TLD pada 5 kV dan 0,1 nA.
Hamburan Sinar-X Sudut Kecil dan Hamburan Sinar-X Sudut Lebar
Percobaan hamburan sinar-X sudut kecil/lebar (SAXS/WAXS) dilakukan di stasiun 12ID-B Advanced Photon Source di Laboratorium Nasional Argonne dengan energi sinar-X sebesar 13,3 keV dan detektor Pilatus 2 m yang terletak ≈2 m dari sampel. Semua sampel dimasukkan ke dalam kapiler kuarsa dan disegel. Semua pengukuran dilakukan pada suhu ruangan.
Uji Destruktif Sel Kantong
Untuk mengevaluasi keamanan dan keandalan zPU-SPE dalam kondisi ekstrem, uji destruktif dilakukan pada sel kantong kemasan lunak. Sel kantong pertama kali dibuat dan diputar selama dua siklus pembentukan. Setelah itu, sel dihubungkan ke LED biru (3,0–3,2 V) sebagai indikator visual fungsionalitas. Sel kantong kemudian mengalami tekanan mekanis, termasuk melipat, memotong dengan gunting, dan menusuk dengan pisau, sementara kinerjanya terus dipantau. LED tetap menyala selama pengujian, mengonfirmasi bahwa sel kantong tidak mengalami korsleting meskipun terjadi kerusakan.

