
ABSTRAK
Terapi berbasis protein telah merevolusi pengobatan modern, menangani penyakit kompleks dengan spesifisitas dan kemanjuran yang belum pernah ada sebelumnya. Meningkatnya permintaan akan biologik telah mendorong evolusi praktik biomanufaktur untuk memastikan kualitas yang konsisten dan efisiensi operasional. Pengujian batch tradisional, dengan keterbatasannya yang melekat, digantikan oleh kerangka kerja kualitas berdasarkan desain (QbD) dan teknologi analisis proses (PAT). PAT memfasilitasi pemantauan dan kontrol waktu nyata dengan mengintegrasikan alat analisis canggih dan metodologi berbasis data untuk mengoptimalkan pemrosesan hilir (DSP). Tinjauan ini menyoroti kemajuan terkini dalam alat PAT, termasuk spektroskopi, kromatografi, dan biosensor. Teknik spektroskopi memberikan pengukuran yang cepat dan non-invasif, sementara biosensor menawarkan spesifisitas tinggi untuk memantau atribut kualitas yang kritis. Selain itu, integrasi pemodelan kemometrik dan kembaran digital memungkinkan analisis prediktif dan meningkatkan kontrol proses, membuka jalan bagi rilis waktu nyata (RTR) produk. Meskipun ada tantangan dalam kepatuhan peraturan dan integrasi teknologi, inovasi dalam otomatisasi dan pembelajaran mesin menjembatani kesenjangan ini, mempercepat transisi ke sistem manufaktur cerdas. Artikel ini memberikan evaluasi komprehensif terhadap teknologi analitis yang muncul dan wawasan strategis terhadap integrasinya, yang bertujuan untuk mendukung peralihan industri biofarmasi menuju paradigma manufaktur yang kuat, berkelanjutan, dan adaptif.
Singkatan
ADC
konjugat antibodi-obat
ATF
aliran tangensial bergantian
Berita CNN
jaringan saraf konvolusional
BPK
parameter proses kritis
CQA
atribut kualitas kritis
Kelinci betina
perancangan percobaan
DSP
pemrosesan hilir
IR
spektroskopi inframerah
LSPR
resonansi plasmon permukaan terlokalisasi
Bahasa Inggris
hamburan cahaya multi-sudut
MIR
spektroskopi inframerah menengah
NIR
spektroskopi inframerah dekat
MENEPUK
teknologi analisis proses
PCC
kromatografi arus balik periodik
tolong
kuadrat terkecil parsial
QbD
kualitas berdasarkan desain
QbT
kualitas dengan pengujian
RTR
rilis waktu nyata
SEIRA
spektroskopi serapan inframerah yang ditingkatkan permukaannya
SERBA GUNA
spektroskopi Raman yang ditingkatkan permukaannya
UKM
simulasi kromatografi tempat tidur bergerak
SPFT
filtrasi aliran tangensial lintasan tunggal
TPP
profil produk target
UHPLC
kromatografi cair kinerja ultra tinggi
UPLC
kromatografi cair kinerja ultra
UV-Vis
ultraviolet tampak
VPE
kemiringan lintasan variabel
WGM
galeri mode berbisik
1 Pendahuluan
Terapi berbasis protein sangat berhasil dan merupakan sekitar setengah dari obat terlaris di pasaran. Protein terlibat dalam pensinyalan molekuler, transportasi, pemeliharaan integritas sel dan jaringan, fungsi kekebalan tubuh, dan masih banyak lagi. Oleh karena itu, terapi berbasis protein telah dikembangkan untuk mengatasi masalah yang terkait dengan salah satu fungsi ini. Jenis terapi protein yang umum meliputi antibodi, enzim, faktor koagulasi, hormon, dan sitokin [ 1 ].
Terapi protein, yang sering disebut sebagai biofarmasi atau biologik, memiliki keunggulan inheren dibandingkan obat molekul kecil karena sangat spesifik dan memiliki fungsi kompleks dalam tubuh. Hasilnya, terapi ini cenderung menyebabkan lebih sedikit gangguan pada proses biologis normal dan lebih sedikit efek samping [ 2 ]. Protein ini dapat dimurnikan dari sumber alaminya atau dapat diproduksi secara massal dalam sel inang yang sesuai menggunakan teknologi DNA rekombinan [ 2 ]. Contoh protein yang dimurnikan dari sumber aslinya adalah terapi yang berasal dari plasma, yang meliputi antibodi, faktor pembekuan, dll. [ 3 ].
Penggunaan pertama teknologi DNA rekombinan adalah dalam produksi insulin dari sel inang ( E. coli ) pada tahun 1980-an [ 4 ]. Sejak saat itu, industri biofarmasi telah mengalami pertumbuhan yang luar biasa, dan sekarang mencakup portofolio biologik baru termasuk antibodi monoklonal [ 5 ], antibodi bio-spesifik [ 6 ], protein fusi [ 7 ] dan konjugat obat antibodi (ADC) [ 8 ]. Pada tahun 2023, lebih dari 350 terapi protein telah disetujui oleh FDA [ 1 ]. Terapi inovatif ini menawarkan pilihan pengobatan bagi pasien dengan kondisi yang melemahkan yang sebelumnya tidak dapat diobati, sehingga memiliki permintaan, pertumbuhan, dan pangsa pasar yang besar dalam keseluruhan pasar farmasi. Antibodi monoklonal merupakan obat yang paling laris diantara protein terapi, dan beberapa contoh obat yang paling laku di pasaran adalah Humira (adalimumab) dari AbbVie untuk mengobati berbagai patologi autoimun, Revlimid (lenalidomide) dari Celgene yang digunakan untuk mengobati multiple myeloma dan Opdivo (nivolumab) dari Bristol-Myers-Squibb sebagai imunoterapi untuk berbagai jenis kanker [ 9 ].
Dengan permintaan untuk biologik yang tumbuh secara eksponensial, ada juga kebutuhan yang meningkat untuk memastikan kemanjuran dan keamanan produk obat ini, yang memerlukan sistem penilaian dan kontrol kualitas yang efisien. Secara tradisional, pengujian batch telah dilakukan untuk memastikan kualitas produk obat, di mana obat yang diproduksi dipilih secara acak untuk setiap batch untuk pengujian. Ini memiliki dua kelemahan utama: (i) kualitas hanya diketahui setelah pembuatan obat, meninggalkan ruang lingkup yang sangat terbatas untuk tindakan perbaikan, yang berpotensi menyebabkan batch yang ditolak atau gagal dan (ii) pendekatan ini mengasumsikan bahwa semua unit dalam satu batch seragam tanpa variabilitas apa pun, dan keputusan untuk pelepasan produk dibuat berdasarkan analisis satu unit representatif untuk setiap batch [ 10 ]. Hal ini meningkatkan risiko distribusi obat-obatan berkualitas buruk. Faktanya, industri farmasi menghabiskan hingga 20% setiap tahun untuk menangani produk yang cacat, yang setara dengan 20% dari penjualan tahunan [ 11 ], yang memberikan beban keuangan yang sangat besar. Tantangan ini sangat penting mengingat pertumbuhan industri ini yang sangat pesat, dengan pendapatan global mencapai sekitar $1,6 triliun pada tahun 2023 [ 12 ].
Kelemahan pendekatan kualitas melalui pengujian (QbT) bahkan lebih terasa pada biofarmasi, karena biofarmasi lebih kompleks dan melibatkan protein terapeutik yang 50–1000 kali lebih besar daripada obat molekul kecil. Tidak seperti molekul kecil, yang diproduksi melalui sintesis kimia, sebagian besar biofarmasi diproduksi melalui biosintesis, menggunakan organisme yang dimodifikasi secara genetik [ 10 ].
Protein rekombinan diproduksi menggunakan berbagai sistem ekspresi, seperti bakteri, ragi, serangga dan sel mamalia [ 2 ], dalam suatu proses yang dikenal sebagai pemrosesan hulu. Proses ini dimulai dengan pemilihan sel inang yang cocok untuk mengekspresikan protein target, diikuti oleh perbanyakan garis sel melalui tahapan-tahapan—dimulai dalam tabung pengocok dan bioreaktor benih sebelum transfer akhir ke bioreaktor produksi. Bergantung pada organisme inang, protein target diproduksi secara intra atau ekstraseluler [ 13 ]. Ini diikuti oleh pemrosesan hilir, untuk mengekstraksi dan memurnikan produk akhir, yang meliputi beberapa langkah seperti pemulihan produk dari media kultur, inaktivasi virus, penangkapan protein dan pemurnian berurutan menggunakan berbagai teknik [ 14 ].
Kompleksitas inheren dari proses manufaktur dan sedikit kontrol atas biosintesis dibandingkan dengan sintesis kimia molekul kecil [ 10 ] memerlukan pemahaman menyeluruh tentang proses dan pendekatan yang lebih canggih untuk memastikan kualitas biofarmasi. Dewan Internasional untuk Harmonisasi Persyaratan Teknis untuk Farmasi untuk Penggunaan Manusia (ICH) memperkenalkan kualitas berdasarkan desain (QbD), yang mendefinisikannya sebagai ‘ Pendekatan sistematis untuk pengembangan yang dimulai dengan tujuan yang telah ditentukan sebelumnya dan menekankan pemahaman produk dan proses serta kontrol proses, berdasarkan ilmu pengetahuan yang baik dan manajemen risiko kualitas ‘ [ 15 ].
Penerapan QbD (Gambar 1 ) diawali dengan mendefinisikan profil target mutu produk (qTPP) untuk produk akhir. Menurut ICH, qTPP didefinisikan sebagai ‘ Ringkasan prospektif karakteristik mutu produk obat yang idealnya akan dicapai untuk memastikan mutu yang diinginkan, dengan mempertimbangkan keamanan dan khasiat produk obat ‘ [ 15 ]. Mendefinisikan qTPP membentuk dasar untuk mencantumkan semua atribut mutu kritis (CQA) potensial, yang merupakan sifat fisik, kimia, atau biologi yang harus tetap dalam rentang atau batas tertentu untuk memastikan qTPP. Parameter proses tertentu, yang dikenal sebagai parameter proses kritis (CPP), memiliki variabilitas yang memengaruhi CQA dan oleh karena itu harus dipantau atau dikontrol [ 15 ].
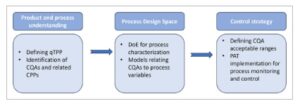
GAMBAR 1
Buka di penampil gambar
Gambaran umum langkah-langkah yang terlibat dalam implementasi QbD.
QbD melibatkan (i) identifikasi CPP dan CQA yang tepat, dan (ii) merancang proses untuk memberikan atribut-atribut ini guna mencapai qTPP. Pada dasarnya, QbD bertujuan untuk membangun ‘ruang desain’ di mana kualitas dibangun ke dalam proses, berbeda dengan mengukur kualitas produk di akhir [ 16 ]. Hal ini memerlukan pemahaman yang lebih baik tentang proses dan dampak parameter proses dan atribut produk pada produk akhir.
‘Ruang desain’ untuk proses dapat didefinisikan dengan melakukan studi karakterisasi proses menggunakan pendekatan desain eksperimen (DoE). Metode ini menghubungkan CQA dengan variabel proses dan membantu memahami efek dari berbagai faktor dan interaksinya. Berdasarkan pemahaman ini, model multidimensi dibangun untuk menghubungkan CQA dengan berbagai faktor, yang memungkinkan definisi rentang yang dapat diterima untuk parameter proses. Strategi kontrol kemudian dibuat untuk memastikan bahwa proses tersebut memenuhi spesifikasi yang telah ditentukan sebelumnya [ 17 ].
Strategi pengendalian dapat digunakan dengan menggunakan teknologi analisis proses (PAT), pendorong utama untuk implementasi QbD. PAT menyediakan platform untuk pemantauan biofarmasi secara terus-menerus dan waktu nyata selama proses produksi, yang memungkinkan pengendalian selama proses. FDA mendefinisikan PAT sebagai ‘ sistem untuk merancang, menganalisis, dan mengendalikan produksi melalui pengukuran tepat waktu (yaitu, selama pemrosesan) dari atribut kualitas dan kinerja penting dari bahan baku dan bahan yang sedang diproses, dengan tujuan memastikan kualitas produk akhir ‘ [ 18 ].
Sasaran utama adalah integrasi teknologi analitis in-line, on-line atau at-line (Gambar 2 ) dengan peralatan manufaktur, untuk pemantauan dan pengendalian proses [ 19 ]. PAT adalah istilah yang mencakup spektrum luas mulai dari sistem pengukuran, strategi pengendalian dan analisis data untuk memungkinkan pemantauan berkelanjutan dan pengendalian proses. Sistem ini penting untuk menerapkan QbD dan memastikan rilis produk secara real-time (RTR) [ 19 ].
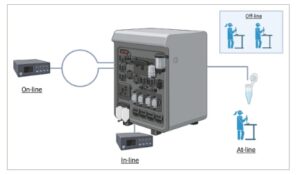
GAMBAR 2
Buka di penampil gambar
Ilustrasi pengaturan alat analisis in-line, on-line, at-line, dan offline untuk pemantauan bioproses. Untuk analisis in-line, alat analisis terintegrasi langsung ke dalam aliran proses, yang memungkinkan pengukuran berkelanjutan dan waktu nyata tanpa pengambilan sampel. Untuk analisis on-line, sebagian aliran proses dialihkan ke penganalisa, tempat pengukuran dilakukan secara waktu nyata atau mendekati waktu nyata, dengan sampel biasanya dikembalikan ke proses. Untuk analisis at-line, sampel diekstraksi secara manual dari proses dan dianalisis segera di dekat jalur produksi. Sebaliknya, analisis offline melibatkan sampel yang dikumpulkan dari proses dan dianalisis di laboratorium atau lokasi terpencil, yang biasanya mengakibatkan penundaan yang lebih lama antara pengambilan sampel dan perolehan hasil.
Mengingat beberapa teknik analisis telah dieksplorasi sebagai alat PAT yang menjanjikan, tinjauan ini akan difokuskan pada alat teknologi analisis proses yang diterapkan pada pemrosesan hilir.
2 Kemajuan dalam Operasi Hilir dan Kontrol Proses
Dalam biomanufaktur, sementara proses hulu didedikasikan untuk mengoptimalkan kondisi untuk budidaya sel dan produksi molekul target, proses hilir berfokus pada ekstraksi dan pemurnian molekul yang diinginkan dari biomassa yang dihasilkan menggunakan kombinasi teknik kromatografi, filtrasi dan sentrifugasi [ 14 ].
Pemrosesan hilir (DSP) dimulai dengan pemanenan dan klarifikasi produk target dari fermentasi hulu atau kaldu kultur sel, diikuti oleh langkah penangkapan awal, seperti kromatografi Protein A untuk antibodi, yang mengonsentrasikan molekul target sambil mengurangi pengotor [ 20 ]. Langkah pemurnian selanjutnya menggunakan berbagai teknik kromatografi yang disesuaikan dengan sifat produk, termasuk pertukaran ion, pengecualian ukuran, atau kromatografi afinitas, untuk mencapai kemurnian dan kualitas yang dibutuhkan [ 21 ]. Tahap akhir sering kali melibatkan ultrafiltrasi/diafiltrasi (UF/DF) untuk memformulasi produk dengan eksipien penstabil untuk memastikan stabilitas jangka panjang dan kesesuaiannya untuk penggunaan terapeutik [ 22 ].
DSP merupakan fase yang sangat penting dan krusial dalam proses produksi, karena melibatkan pemurnian molekul target, yang secara langsung berdampak pada kualitas produk akhir [ 14 ]. Pemurnian seringkali melebihi biaya produksi hulu, sedangkan pemrosesan hilir mencakup 80% biaya produksi, yang sebagian besar disebabkan oleh tingginya biaya resin Protein A dan penyaringan virus [ 14 , 23 ]. Oleh karena itu, menjadi keharusan untuk mengoptimalkan bioproses yang dapat menghasilkan produk berkualitas tinggi secara lebih efisien dengan keunggulan biaya.
Kebutuhan ini telah menyebabkan pergeseran fokus biomanufaktur dari pemrosesan batch-wise tradisional menuju intensifikasi proses dan manufaktur berkelanjutan, di mana semua operasi unit terintegrasi dengan mulus untuk menciptakan aliran tunggal, dengan volume penahanan minimal atau tidak ada di antaranya [ 24 ]. Dalam pemrosesan hulu, bioreaktor perfusi dikembangkan untuk terus-menerus menghilangkan media kultur bekas yang mengandung produk target, mempertahankan kepadatan sel yang optimal dalam bioreaktor untuk kontrol proses yang lebih baik. Pendekatan ini telah menghasilkan kepadatan sel yang lebih tinggi sehingga meningkatkan produktivitas bioreaktor [ 25 ]. Sementara kemajuan tersebut telah dibuat dan mapan untuk pemrosesan hulu, integrasi pemrosesan hilir berkelanjutan masih berkembang [ 26 ].
Upaya telah dilakukan untuk mengembangkan proses manufaktur berkelanjutan untuk pemrosesan hilir. Ini termasuk penggunaan perangkat pemisahan sel seperti aliran tangensial bergantian (ATF) [ 27 ] dan filtrasi aliran tangensial lintasan tunggal (SPTFF) [ 28 ] untuk klarifikasi dan penggunaan kromatografi arus berlawanan periodik (PCC) dan kromatografi tempat tidur bergerak tersimulasi (SMB) [ 29 ] untuk langkah penangkapan dan pemurnian/pemolesan. Ini dicapai dengan menggabungkan bioreaktor perfusi ke filtrasi ATF, di mana aliran cairan bergantian melintasi membran secara tangensial, memungkinkan retensi sel terus menerus sambil membuang media bekas atau limbah dalam proses siklik. Bahan yang dijernihkan, yang mengandung produk, kemudian dapat ditransfer ke langkah penangkapan dan pemolesan berikutnya menggunakan PCC dan SMB, di mana operasi kromatografi yang khas, yaitu, pemuatan, pencucian, elusi dan regenerasi, dijalankan secara seri oleh beberapa kolom secara siklik [ 26 , 30 ]. Manufaktur berkelanjutan yang terintegrasi secara penuh memberikan keuntungan dengan mengurangi biaya, meningkatkan kualitas sambil mempercepat pelepasan produk [ 24 , 26 ]
Dengan industri biofarmasi yang mengalami pergeseran paradigma menuju manufaktur berkelanjutan, pemantauan berkelanjutan menjadi lebih dibutuhkan dari sebelumnya untuk memastikan kontrol proses. Integrasi PAT ke dalam aliran proses untuk mengukur CQA untuk mengoptimalkan parameter proses sangat penting. Implementasi PAT dalam DSP agak terbatas karena berbagai kesulitan yang terkait dengannya [ 26 ]. Tidak seperti pemrosesan hulu, di mana beberapa hari diperlukan untuk kultur sel dan produksi protein terapeutik, pemurnian produk target dalam pemrosesan hilir hanya membutuhkan beberapa jam [ 31 ]. Sementara waktu respons hingga 1 jam masih cukup untuk USP, keputusan proses harus dibuat dalam hitungan detik untuk DSP [ 32 ], menuntut teknologi yang menawarkan pengukuran yang lebih cepat. Menambah tantangan ini adalah kompleksitas inheren protein terapeutik karena bobot molekulnya yang lebih tinggi, beberapa modifikasi pasca-translasi (PTM), varian struktur orde lebih tinggi (HOS) dan/atau interaksi molekuler putatif [ 33 ].
Dalam pemrosesan hilir, memastikan kemurnian produk terapeutik merupakan prioritas tertinggi. CQA umum yang dipantau mencakup pengotor terkait proses seperti protein sel inang (HCP) dan asam nukleat, serta pengotor terkait produk seperti spesies berat molekul lebih tinggi dan lebih rendah (HMW, LMW) dan varian muatan [ 34 ]. Struktur berbeda dari protein yang sama sering kali hadir dalam sediaan biofarmasi, menjadikannya campuran heterogen, termasuk modifikasi pasca-translasi seperti glikosilasi, oksidasi, deamidasi, pembentukan agregat dan fragmen yang memengaruhi stabilitas dan kemanjuran obat [ 35 ]. Glikosilasi terkait-N adalah PTM yang paling umum dan memengaruhi aktivitas biologis, farmakokinetik, dan imunogenisitas protein terapeutik [ 36 ]. Pembentukan agregat selama proses pemurnian merupakan atribut penting untuk dipantau, karena agregat protein telah terbukti menunjukkan imunogenisitas, yang menyebabkan efek samping [ 37 ]. Kompleksitas protein yang melekat dan tuntutan DSP memerlukan alat PAT yang dapat memberikan pengukuran yang lebih cepat dan berthroughput tinggi untuk memastikan efisiensi proses dan kualitas produk.
Pemantauan komprehensif dari semua atribut kualitas kritis (CQA) tidak dapat dicapai dengan teknologi analitis tunggal; sebaliknya, pendekatan terpadu yang menggabungkan beberapa teknik, sensor dan sistem kontrol sangat penting untuk pemantauan dan kontrol proses yang efektif [ 20 , 26 ]. Dalam pemrosesan hilir berkelanjutan, yang dicirikan oleh aliran fluida yang konstan, PAT memainkan peran penting dengan memungkinkan integrasi teknologi in-line, on-line dan at-line. Teknik seperti spektroskopi, kromatografi dan biosensor telah muncul sebagai solusi PAT yang menjanjikan. Bagian selanjutnya dari tinjauan ini menyelidiki kemajuan terbaru dalam alat PAT untuk pemrosesan hilir.
3 PAT dalam Protein DSP
PAT memfasilitasi biomanufaktur melalui berbagai teknik analitis dan model kemometrik [ 38 ]. PAT adalah istilah umum dan mencakup komponen sistem pengukuran, alat multivariat untuk pemodelan prediktif dan strategi kontrol terkait [ 19 ]. Pengukuran dapat dilakukan secara real time atau mendekati real time dengan analisis in-line, on-line dan at-line. Namun, kebutuhan pra-perlakuan sampel dapat menjadi kendala dalam penerapan teknik analitis secara in-line atau on-line. Akuisisi dan persiapan sampel manual juga memperkenalkan variabilitas karena kesalahan manusia dalam penanganan sampel [ 39 ]. Kemajuan dalam metode pengambilan sampel otomatis telah sangat berguna untuk mengatasi tantangan ini. Berbagai stasiun kerja penanganan cairan robotik telah dikomersialkan yang dapat mengotomatiskan persiapan dan pra-perlakuan sampel. Agilent Bravo, Kingfisher Flex, TECAN, Hamilton Microlab, Formulatrix dan Beckman Coulter Biomek adalah beberapa contoh platform penanganan cairan otomatis tersebut [ 40 – 42 ]. Telah ada pula usaha-usaha baru-baru ini untuk mengembangkan platform end-to-end yang dapat melakukan persiapan dan analisis sampel secara otomatis [ 43 , 44 ]. Sistem pengambilan sampel otomatis seperti MAST dan Seg-Flow dapat mengambil sampel dari aliran bioproses dan mengirimkannya ke perangkat analitis untuk memastikan analisis yang lancar [ 45 – 47 ].
Spektroskopi telah menjadi teknik yang paling umum digunakan untuk analisis real-time karena sifatnya yang tidak merusak dan kemudahan integrasi in-line atau on-line ke aliran proses. Namun, dengan kemajuan dalam instrumentasi analitis dan metode pengambilan sampel otomatis, berbagai teknik seperti kromatografi on-line dan integrasi in-line biosensor sedang dieksplorasi untuk PAT. Teknik PAT yang muncul untuk pemantauan proses hilir diilustrasikan dalam Gambar 3. Untuk pemantauan real-time, pengukuran analitis biasanya diikuti oleh pembangunan model kemometrik, yang memungkinkan kontrol proses yang dinamis. Di bagian selanjutnya, kemajuan terbaru dalam teknik analitis (Bagian 3.1–3.4) serta alur kerja data, termasuk pembangunan model dan kontrol proses (Bagian 3.5) dibahas (Gambar 4 ).
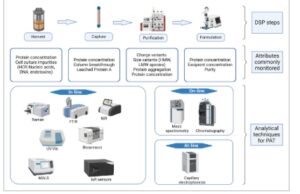
GAMBAR 3
Buka di penampil gambar
Teknik PAT yang muncul untuk pemantauan
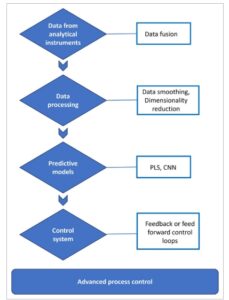
GAMBAR 4
Buka di penampil gambar
Gambaran umum alur kerja data yang terlibat dalam pemantauan bioproses.
3.1 Teknik Spektroskopi
Berbagai teknik spektroskopi telah digunakan sebagai alat PAT. Teknik spektroskopi vibrasi meliputi spektroskopi Raman, spektroskopi inframerah-menengah (MIR) dan spektroskopi inframerah-dekat (NIR), yang mengidentifikasi molekul berdasarkan getaran ikatannya. Spektroskopi ultraviolet-tampak (UV-Vis), di sisi lain, mengidentifikasi molekul berdasarkan transisi energi elektron. Teknik spektroskopi adalah metode pilihan sebagai alat PAT karena (i) mereka dapat memberikan informasi kuantitatif dan kualitatif tentang beberapa analit dalam sampel dan (ii) mereka dapat dengan mudah diintegrasikan dalam pengaturan in-line dengan menggunakan sel aliran atau probe serat optik. Dalam pemantauan waktu nyata, pengukuran spektroskopi sering diintegrasikan dengan alat analisis data multivariat (MVDA) untuk menganalisis dan mengekstrak informasi yang berarti dari kumpulan data spektral yang besar [ 48 ].
3.1.1 Spektroskopi Inframerah
MIR dan NIR adalah dua teknik spektroskopi Inframerah yang paling umum digunakan dalam teknologi analisis proses.
3.2 MIR
Spektroskopi MIR (rentang panjang gelombang dari 2500 hingga 25.000 nm) mengidentifikasi molekul berdasarkan getaran fundamentalnya, karena molekul tersebut menyerap cahaya inframerah menengah pada panjang gelombang tertentu. Penyerapan tersebut sesuai dengan perubahan momen dipol molekul, yang menghasilkan ‘sidik jari molekul’, sehingga memungkinkan identifikasi ikatan kimia dan gugus fungsi secara terperinci [ 49 ]. Karena MIR didasarkan pada getaran fundamental, MIR dapat memberikan informasi langsung tentang getaran spesifik ikatan, sehingga menjadikannya teknik yang ampuh untuk mengidentifikasi dan mengukur komponen molekuler tertentu dan detail struktural dalam biomolekul. Spektroskopi MIR yang diterapkan dengan transformasi Fourier berguna dalam mengukur konsentrasi produk dalam matriks kompleks [ 50 ].
Spesifisitas dan sensitivitas tinggi dari MIR berasal dari sifat biomolekul yang sangat menyerap di wilayah spektral ini [ 51 ]. Pita protein yang paling menonjol ditemukan di wilayah amida I (∼1650 cm −1 ) dan amida II (∼1550 cm −1 ). Salah satu keterbatasan MIR adalah pita serapan kuat yang tumpang tindih dengan wilayah amida I (∼∼1645 cm −1 ) untuk air, biasanya dalam rentang molar, sedangkan untuk protein, penyerapan berada dalam rentang mM hingga µM yang mengarah ke saturasi sinyal cepat, yang membutuhkan pengurangan absorbansi air [ 52 ]. MIR juga membutuhkan persiapan sampel yang ekstensif, dengan pelarut yang tidak memiliki absorbansi di wilayah spektral ini untuk meminimalkan interferensi spektral [ 51 ].
Namun, dengan reflektansi total yang dilemahkan (ATR) dan spektroskopi inframerah transformasi Fourier (FTIR), keterbatasan ini telah dikurangi ke tingkat yang lebih besar. FTIR memungkinkan pengukuran konsentrasi produk dalam matriks kompleks [ 50 ]. ATR menggunakan elemen refleksi internal (IRE) untuk refleksi internal total yang dilemahkan, sehingga ketika sampel ditempatkan dalam kontak dekat dengan IRE, hanya lapisan tipis yang diperiksa, mencegah saturasi penyerapan oleh molekul pengganggu seperti air [ 53 ].
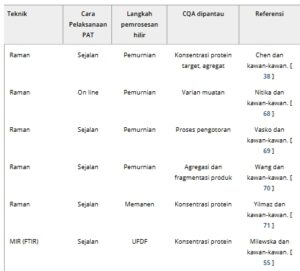
ATR-FTIR dapat memantau beberapa parameter secara real time, dan merupakan alat yang efektif ketika dikombinasikan dengan algoritma untuk membuat prediksi dan kontrol secara real-time. Alat ini telah digunakan untuk memantau langkah-langkah proses hilir protein secara at-line [ 54 ]. Penggunaan probe serat optik ATR memudahkan untuk mengintegrasikannya secara in-line. Baru-baru ini, ATR-FTIR juga telah diimplementasikan secara in-line selama langkah UFDF, untuk memantau konsentrasi protein dengan algoritma kalibrasi satu titik sederhana [ 55 ] atau protein dan berbagai konsentrasi eksipien, dengan model analisis data multivariat (MVDA) [ 56 ]. Dalam kedua kasus, pengukuran cepat dalam hitungan detik dan prediksi konsentrasi yang akurat tercapai. Kemajuan dalam MIR seperti spektroskopi penyerapan inframerah yang ditingkatkan permukaan (SEIRA) dan metode IR yang ditingkatkan ujung [ 57 , 58 ] dapat meningkatkan sensitivitas pengukuran beberapa kali lipat dan telah dieksplorasi sebagai alat pemantauan in situ [ 59 ], menunjukkan potensi besar untuk juga dipertimbangkan sebagai alat PAT untuk pemrosesan hilir.
3.3 NIR
Spektroskopi NIR (rentang panjang gelombang 800–2500 nm), menginduksi getaran nada atas dan kombinasi daripada getaran fundamental, seperti yang terlihat pada MIR. Getaran energi yang lebih tinggi ini muncul sebagai puncak yang luas dan sering tumpang tindih dalam spektrum NIR, memberikan penilaian fitur molekuler yang lebih umum tetapi cepat. NIR sangat sensitif terhadap ikatan yang melibatkan hidrogen, seperti ikatan C─H, N─H dan O─H, sehingga sangat cocok untuk menyelidiki kandungan air dan molekul organik dalam matriks kompleks [ 60 ].
Absorbansi molekul di wilayah NIR beberapa kali lebih rendah daripada MIR, memungkinkan penetrasi lebih dalam dan memerlukan persiapan sampel minimal [ 51 ]. Meskipun kurang spesifik daripada MIR karena puncak yang lebih luas, kemampuan NIR untuk menembus lebih dalam ke dalam sampel dan mengakomodasi analisis throughput tinggi [ 60 ] membuatnya sangat berharga dalam memantau konsentrasi dan mendeteksi variasi dalam komposisi kimia, terutama bila dikombinasikan dengan model kemometrik untuk analisis kuantitatif. FDA menekankan pentingnya membangun model kemometrik yang andal untuk pengukuran NIR [ 61 ]. Kemampuan NIR untuk digunakan langsung pada sampel tanpa memerlukan persiapan sampel yang ekstensif [ 51 ] membuatnya sangat berlaku untuk analisis waktu nyata, di mana pengukuran cepat diperlukan.
NIR telah digunakan dalam pengaturan on-line untuk memantau PEGylation protein, yang merupakan atribut kualitas penting untuk dipantau selama pemrosesan hilir protein terkonjugasi. Spektrum NIRS dikumpulkan secara real time setiap 3 detik, yang kemudian diikuti dengan pembuatan model untuk ekstraksi informasi dan kontrol proses [ 62 ].
Mirip dengan MIR, teknik transformasi Fourier juga dapat digunakan dengan NIR. Studi terbaru telah menggunakan FT-NIR untuk pemantauan proses hilir. Thakur et al. memantau pemuatan kolom menggunakan pengaturan FT-NIR on-line, di mana konsentrasi produk target dalam kaldu yang dipanen dan efluen kolom dari kromatografi Protein A diukur secara real time, untuk setiap 3 detik dan terobosan kolom terdeteksi dengan sukses dengan akurasi tinggi [ 63 ]. Telah diintegrasikan in-line untuk pemantauan simultan konsentrasi protein dan eksipien dalam formulasi antibodi selama UFDF, dan kuantifikasi dilakukan secara real time, dalam beberapa detik [ 64 ]. Dalam kedua kasus, kontrol proses real-time tercapai.
FT-NIR juga telah digunakan untuk memantau proses berkelanjutan, khususnya untuk mengukur konsentrasi dalam aliran umpan dan retentat selama langkah UFDF dengan filtrasi aliran tangensial satu lintasan (SPTFF). Dengan menerapkan model kalibrasi yang tepat, prediksi konsentrasi yang akurat dapat dicapai, memfasilitasi kontrol proses yang efektif [ 65 ].
3.3.1 Spektroskopi Raman
Spektroskopi Raman didasarkan pada hamburan foton yang tidak elastis, di mana sebagian kecil cahaya yang datang mengalami hamburan tidak elastis, yang mengakibatkan pergeseran energi yang sesuai dengan mode getaran molekul tertentu yang ada. Pergeseran ini, yang disebut pergeseran Raman, memungkinkan identifikasi komposisi molekuler dan informasi struktural sampel. Sementara IR sensitif terhadap perubahan dipol, efek Raman sensitif terhadap perubahan polarisasi [ 66 ]. Oleh karena itu, IR dan Raman dapat digunakan untuk mendapatkan informasi pelengkap, yang berguna untuk mengkarakterisasi atribut kimia dan struktural.
Raman memerlukan persiapan sampel minimal dan bersifat non-invasif serta tidak merusak sampel. Ini adalah salah satu teknik yang paling banyak digunakan dalam PAT, dan dengan munculnya pembelajaran mesin dan pengembangan model, deteksi dan prediksi yang akurat dapat dilakukan. Pengembangan sel aliran portabel untuk Raman [ 67 ] telah membuat teknik ini mudah diimplementasikan secara inline atau online untuk memantau atribut kualitas. Beberapa penelitian telah dipublikasikan dalam beberapa tahun terakhir di mana Raman digunakan untuk pemantauan waktu nyata dari berbagai langkah pemrosesan hilir.
Chen et al. menggunakan spektroskopi Raman untuk pemantauan CQA in-line dari antibodi monoklonal IgG1 (mAb) selama proses kromatografi Protein A, di mana mereka mengembangkan model prediktif yang menunjukkan akurasi prediktif tinggi untuk berbagai CQA termasuk konsentrasi dan agregat protein target [ 38 ]. Dalam Nitika et al. [ 68 ], spektroskopi Raman yang digabungkan dengan kerangka kerja jaringan saraf konvolusional memungkinkan pemantauan on-line real-time dan penentuan varian muatan selama kromatografi pertukaran kation (CEX) dari mAb. Dalam Vasko et al. [ 69 ], pemantauan in-line dari pengotor proses selama pemurnian protein rekombinan dikembangkan menggunakan model kalibrasi berdasarkan spektroskopi Raman dan NIR. Wang et al. menerapkan spektroskopi Raman in-line untuk mengukur agregasi dan fragmentasi produk secara real time, mengembangkan model kalibrasi, mencapai pengukuran kualitas yang akurat setiap 38 detik. Penulis ini mengintegrasikan otomatisasi perangkat keras dan teknik pembelajaran mesin untuk meningkatkan throughput data [ 70 ].
Spektroskopi Raman juga telah digunakan selama tahap panen untuk mengukur konsentrasi mAb secara langsung dari aliran permeat bioreaktor perfusi. Dengan mengintegrasikan Raman dengan pemodelan kemometrik, prediksi konsentrasi yang akurat dapat dicapai. Hal ini menunjukkan efektivitas spektroskopi Raman sebagai alat PAT dalam pengaturan manufaktur berkelanjutan [ 71 ].
Keuntungan spektroskopi Raman dibandingkan spektroskopi IR adalah bahwa spektrum Raman memiliki gangguan air yang minimal dan dengan demikian dapat digunakan dalam menganalisis sampel berair atau spesimen biologis di mana air merupakan komponen yang signifikan tanpa mengorbankan kejernihan spektral. Salah satu keterbatasan Raman adalah sensitivitasnya terhadap latar belakang fluoresensi, yang dapat mengaburkan sinyal Raman dalam sampel tertentu [ 72 ]. Raman juga sensitif terhadap suhu sampel, dengan suhu yang lebih tinggi menyebabkan garis Raman difus, yang memerlukan penyesuaian suhu. Sinyal Raman seringkali lebih lemah daripada sinyal dalam metode spektroskopi lainnya, yang menyebabkan tantangan dalam mendeteksi analit konsentrasi rendah [ 73 ].
Banyak dari keterbatasan ini telah diatasi melalui kemajuan terkini, dengan pengembangan beberapa varian teknik spektroskopi Raman yang menawarkan keuntungan unik dibandingkan metode tradisional. Ada upaya untuk mengurangi interferensi fluoresensi pada sinyal Raman dengan menggunakan panjang gelombang laser merah atau merah tua, Raman beresolusi waktu, dan spektroskopi perbedaan Raman eksitasi bergeser (SERDS). Varian Raman yang disempurnakan meliputi Raman resonansi, Raman yang ditingkatkan permukaan (SERS), Raman resonansi yang ditingkatkan permukaan (SERRS), dan Raman yang ditingkatkan ujung (TERS), yang semuanya digunakan karena keuntungan inherennya termasuk peningkatan sinyal Raman, pengurangan batas deteksi, dan penggunaan volume sampel yang dikurangi [ 74 ]. Untuk pembahasan yang lebih rinci tentang teknik Raman yang ditingkatkan permukaan, dan implementasinya, pembaca didorong untuk merujuk ke artikel tinjauan yang sangat bagus yang tersedia pada topik ini [ 74 , 75 ]. Teknik spektroskopi Raman tingkat lanjut bergantung pada instrumentasi yang mahal, yang sering kali menghambat implementasi rutinnya. Namun, biaya diperkirakan akan menurun seiring berjalannya waktu, sehingga memungkinkan adopsi yang lebih luas dalam industri biofarmasi [ 73 ].
Dalam upaya untuk mengurangi biaya operasi, Goldrick et al. mengeksplorasi potensi mikroskop spektroskopi Raman throughput tinggi dalam memantau berbagai kondisi elusi dan kemurnian monomer dalam langkah kromatografi pertukaran kation (CEX) dari protein fusi Fc dalam pemrosesan hilir. Dikombinasikan dengan pemodelan kemometrik, metode ini mampu mengklasifikasikan sampel berdasarkan konsentrasi protein dan kemurnian monomer. Namun, metode ini tidak mampu mendeteksi spesies dengan berat molekul rendah dan tinggi secara akurat. Namun, klasifikasi sampel berdasarkan konsentrasi dan kemurnian memungkinkan penentuan prioritas dan pengurangan sampel yang dianalisis dengan pengaturan HPLC dan UV biasa [ 76 ]. Penulis mengklaim bahwa metode ini berpotensi mengurangi biaya modal dan operasi dengan mengurangi ketergantungan pada beberapa teknik analitis terpisah. Adaptasi dan studi lebih lanjut diperlukan untuk menunjukkan efektivitas teknik ini untuk pemantauan proses hilir.
3.3.2 Spektroskopi UV-Vis
Spektroskopi UV-Vis (rentang panjang gelombang 10–800 nm) didasarkan pada transisi elektron, bukan pada keadaan vibrasi seperti yang terlihat pada Raman atau IR. Penyerapan cahaya ultraviolet (10–400 nm) dan cahaya tampak (400–800 nm) oleh sampel menyebabkan elektron bertransisi dari keadaan dasar ke keadaan tereksitasi. Transisi ini merupakan karakteristik ikatan dan gugus fungsi, dan absorbansi cahaya berbanding lurus dengan konsentrasi analit. Oleh karena itu, spektrum absorbansi yang dihasilkan memberikan informasi kuantitatif tentang konsentrasi dan struktur kimia analit [ 77 ].
Karena UV-Vis terutama mendeteksi kromofor, wilayah molekuler tempat eksitasi elektron lebih mungkin terjadi, hal ini sangat berguna untuk menganalisis sistem terkonjugasi, termasuk protein dan asam nukleat, dan memantau perubahan konsentrasi secara real time [ 77 ].
Rolinger et al. menggunakan Raman dan UV dalam pengaturan in-line untuk mengukur konsentrasi mAb dalam kolom efluen selama fase beban dalam kromatografi Protein A. Ini dikombinasikan dengan pemrosesan data berat untuk memperoleh wawasan dari data spektral, termasuk beberapa langkah pra-pemrosesan data, pemodelan menggunakan PLS dan CNN diikuti oleh penggabungan kedua set data. Pada akhirnya, penelitian menyimpulkan bahwa, pemodelan PLS berbasis data UV saja memiliki kinerja yang unggul dalam memprediksi konsentrasi mAb [ 78 ].
Penelitian lain menggunakan sensor fotometrik LED panjang gelombang ganda yang dikonfigurasi pada dua panjang gelombang berbeda, di mana absorbansi UV digunakan dalam menentukan konsentrasi protein selama proses filtrasi aliran tangensial (TFF) [ 79 ].
Kemajuan penting dalam metode analisis UV-Vis adalah pengembangan instrumen variable pathlength slope (VPE), yang menggunakan beberapa panjang lintasan untuk mengukur absorbansi secara otomatis pada panjang gelombang tertentu [ 80 ]. Pengukuran konsentrasi protein yang akurat dapat dilakukan dengan VPE, bahkan dengan protein konsentrasi tinggi tanpa memerlukan pengenceran [ 81 ]. VPE bersama dengan sel aliran dapat dengan mudah diintegrasikan secara in-line untuk berbagai operasi unit, yang memungkinkan akuisisi sinyal UV secara real-time [ 80 ]. Berbagai instrumen yang menggunakan teknologi panjang lintasan variabel telah dikomersialkan dengan nama merek CTech SoloVPE, CTech FlowVPE dan CTech FlowVPX. Spektrometer UV-Vis panjang lintasan variabel telah digunakan untuk pemantauan in-line konsentrasi protein selama UFDF pada skala lab [ 82 ]. Namun, ada beberapa tantangan dalam mengimplementasikan sistem VPE karena dikontrol komputer, dapat menghabiskan ruang yang signifikan, melibatkan berbagai komponen yang dapat dipertukarkan dan memerlukan pembersihan rutin serta verifikasi izin [ 79 ].
3.4 Kromatografi dan Teknik Hyphenated
Pemisahan senyawa secara kromatografi berdasarkan pengecualian ukuran atau pertukaran ion telah digunakan secara rutin dalam karakterisasi produk dalam pengujian rutin. Kromatografi yang digabungkan dengan detektor yang sesuai dapat secara efisien mengidentifikasi CQA seperti varian muatan, varian ukuran, dan pola glikosilasi [ 83 ]. Hal ini sebelumnya tidak dipertimbangkan untuk analisis waktu nyata karena waktu yang dibutuhkan untuk pemisahan senyawa dengan kromatografi.
Kemajuan dalam solusi pengambilan sampel otomatis telah memungkinkan untuk menggunakan kromatografi dalam pengaturan on-line, di mana larutan sampel dapat secara otomatis diambil dari aliran proses dan diteruskan ke analisis kromatografi. Kromatografi cair kinerja ultra on-line (UPLC), berdasarkan pertukaran ion, telah digunakan oleh Godbole et al., pada tahun 2024 untuk menentukan rasio mAb yang diformulasikan bersama. UPLC mampu secara efektif membedakan dan mengidentifikasi antibodi yang diformulasikan bersama meskipun kesamaan strukturalnya tinggi [ 84 ] yang akan menjadi tantangan dengan teknik lain seperti spektroskopi. Oleh karena itu, UPLC on-line memungkinkan pemisahan fisik antibodi dan deteksinya secara otomatis dan real-time in-situ. Meskipun ini secara signifikan mengurangi waktu penyelesaian analitis, masih dibutuhkan waktu pengukuran 30 menit per sampel [ 84 ], yang menyoroti perlunya mempercepat waktu pemisahan untuk dapat menggunakan kromatografi sebagai alat PAT yang realistis.
Meskipun ada keterbatasan, adaptasi pengaturan kromatografi untuk analisis waktu nyata terus berkembang. Pengaturan HPLC khusus, yang dirancang khusus untuk pemantauan waktu nyata, dengan pengambilan sampel dan pemrosesan data otomatis telah dikembangkan untuk memantau berbagai CQA seperti varian ukuran dan kapasitas beban kolom maksimum, selama langkah penangkapan dan pemurnian dalam pemrosesan hilir. Pengaturan ini menghasilkan pengukuran yang lebih cepat dengan waktu pengambilan sampel yang lebih pendek berkisar antara 1,30 hingga 2,35 menit [ 85 ].
Spektrometri massa telah digunakan secara luas dalam analisis off-line produk obat karena throughput dan sensitivitasnya yang tinggi, biasanya dikaitkan dengan kromatografi. Spektrometri massa dapat mendeteksi berbagai atribut kualitas, seperti pola glikosilasi [ 86 ], varian muatan, agregat, dan pengotor terkait proses seperti protein sel inang (HCP) [ 87 ]. Namun, spektrometri massa belum dipertimbangkan untuk PAT karena tidak memungkinkan untuk diterapkan secara in-line atau on-line, karena memerlukan persiapan sampel dan kompleksitas terkait [ 88 ].
Solusi untuk keterbatasan ini dieksplorasi oleh Diehm et al., pada tahun 2024, dengan menggabungkan kromatografi tempat tidur bergerak yang disimulasikan mikro (µSMB) untuk persiapan sampel dan menggunakan MS untuk pengukuran. Ini diimplementasikan dalam pengaturan daring dalam PAT. Tidak seperti metode kromatografi tradisional, di mana terdapat lebih banyak waktu yang dibutuhkan untuk pemisahan, µSMB mampu memproses sampel dalam jumlah waktu yang jauh lebih sedikit (2–8 menit), yang mengarah pada pengukuran MS CQA yang berkelanjutan [ 88 ].
Kemajuan signifikan dalam bidang spektrometri massa adalah pengembangan metode multi-atribut (MAM) untuk memantau beberapa atribut kualitas bioterapi secara bersamaan. Ini adalah solusi analitis yang ditargetkan dan dioptimalkan yang menggunakan kombinasi data MS resolusi tinggi dan perangkat lunak yang sesuai yang memungkinkan identifikasi otomatis dan kuantifikasi relatif PTM penting [ 89 ]. MAM telah menjadi alat yang berharga untuk pengendalian kualitas bioterapi [ 90 ]. Kegunaannya untuk analisis waktu nyata dalam pengaturan PAT baru-baru ini dieksplorasi di mana sistem MAM online otomatis ujung ke ujung dikembangkan untuk pemantauan atribut kualitas selama manufaktur hulu [ 91 ]. Kemampuan MAM yang ditunjukkan menjadikannya alat yang menjanjikan untuk juga dieksplorasi untuk alur kerja DSP. Untuk pembahasan yang lebih rinci tentang aplikasi MAM dalam analisis biofarmasi, pembaca didorong untuk merujuk ke tinjauan komprehensif dalam ref. [ 92 ].
Secara keseluruhan, kromatografi yang digabungkan dengan spektrometri massa atau teknik deteksi lainnya telah digunakan secara luas untuk analisis off-line, menawarkan spesifisitas tinggi, sensitivitas dan kemampuan untuk memantau beberapa atribut secara bersamaan. Namun, integrasinya ke dalam lingkungan waktu nyata menghadirkan tantangan besar. Kemajuan seperti kromatografi mikro-SMB telah secara signifikan mengurangi waktu pengambilan sampel dan pengukuran, namun ini tetap dalam hitungan menit, yang jauh lebih lambat daripada respons skala detik yang dapat dicapai dengan metode spektroskopi. Sementara implementasi kromatografi on-line secara teknis layak, integrasi in-line sejauh ini secara inheren tidak praktis karena sifat operasional teknik tersebut. Kendala ini menggarisbawahi keterbatasan kromatografi untuk kontrol proses waktu nyata dalam pemrosesan hilir, di mana pemantauan yang cepat dan dinamis sangat penting.
3.5 Biosensor
Berbagai teknik biosensing telah digunakan sebagai alat PAT dalam upaya untuk meningkatkan spesifisitas, sensitivitas, kecepatan dan kemudahan deteksi. Biosensor berbasis fluoresensi menggunakan ligan berlabel fluoresensi untuk mengikat analit target, dan deteksi didasarkan pada perubahan intensitas fluoresensi. Reporter fluoresensi yang diimobilisasi baru-baru ini digunakan dalam pemantauan langkah penangkapan dalam pemrosesan hilir, di mana terobosan kolom sebesar 5% dapat dideteksi [ 93 ]. Miniaturisasi teknik analitis memungkinkan waktu operasi yang lebih pendek, hanya memerlukan volume sampel yang kecil dan dapat diimplementasikan dengan mudah secara in-line atau on-line. Pedro et al., mengeksplorasi potensi ini dengan miniaturisasi sensor mikrofluida berbasis pewarna fluoresensi, dan pengukuran agregasi protein dilakukan dalam waktu kurang dari 10 menit. Namun, ini dilakukan dalam pengaturan at-line dan kinerjanya dalam pengaturan in-line atau on-line belum diselidiki [ 94 ].
Biosensor berbasis resonansi plasmon permukaan terlokalisasi (LSPR) baru-baru ini muncul sebagai teknik yang menjanjikan untuk pemantauan waktu nyata. LSPR muncul dari osilasi kolektif elektron bebas dalam nanopartikel logam mulia, seperti emas atau perak, ketika disinari dengan cahaya tampak, menghasilkan pita kepunahan yang berbeda yang dikenal sebagai pita LSPR. Biosensing LSPR mendeteksi interaksi biomolekuler dengan memantau pergeseran dalam pita ini. Ketika protein target mengikat ligan yang diimobilisasi pada permukaan sensor yang mengandung nanopartikel ini, ia mengubah indeks bias lokal di dekat nanostruktur, mengubah kondisi resonansi. Pergeseran optik ini, yang menunjukkan peristiwa pengikatan, direkam secara real time dengan presisi pikometer (pm) [ 95 , 96 ].
Biosensor LSPR telah digunakan untuk pemantauan in-line dari langkah penangkapan Protein A, yang memungkinkan deteksi sensitivitas tinggi dari terobosan kolom dengan mengukur konsentrasi produk serendah 2 µg/mL dalam efluen, yang memungkinkan identifikasi awal kebocoran kolom [ 96 ]. Sifat pengikatan juga dapat dimanfaatkan untuk mengukur atribut yang berbeda, selain pengukuran konsentrasi. Misalnya, agregat telah meningkatkan afinitas nyata karena interaksinya dengan banyak ligan. Berdasarkan prinsip ini, perbedaan antara agregat dan monomer dapat dibuat [ 97 ]. Efek aviditas yang mengarah pada respons pengikatan yang lebih tinggi dalam biosensor LSPR telah digunakan untuk memantau agregat protein selama pemurnian afinitas, yang memungkinkan deteksi in-line agregat serendah 1% [ 98 ].
Biosensor LSPR kurang sensitif terhadap perubahan suhu, komposisi sampel dan getaran, dan tidak seperti teknik spektroskopi, mereka tidak memerlukan analisis data tingkat lanjut untuk mengekstraksi konsentrasi produk [ 96 ]. Ia juga memiliki waktu respons yang singkat di mana pengukuran dapat dilakukan dalam beberapa detik dan rentang dinamis yang besar dan dapat disetel dengan sedikit kebutuhan untuk pra-perlakuan sampel [ 99 ].
Namun, tantangan utama terletak pada ketergantungan pada ligan yang sangat spesifik, karena sensitivitas dan spesifisitas biosensor LSPR ditentukan oleh pemilihan ligan. Mengidentifikasi ligan yang sesuai bisa jadi sulit untuk analit tertentu. Meskipun demikian, teknik ini menunjukkan harapan besar untuk pemantauan proses secara real-time karena integrasinya yang mudah untuk aplikasi in-line, pengaturan yang ringkas, dan kemampuan pengukuran yang cepat.
Berbagai teknik biosensing terus bermunculan, contohnya termasuk resonator whispering gallery mode (WGM) di mana peristiwa pengikatan tunggal dalam volume kecil dapat diukur karena fitur optomekanisnya yang kuat [ 100 ] dan biosensing by particle motion (BPM), teknologi penginderaan berbasis afinitas dengan resolusi partikel tunggal dan molekul tunggal [ 101 ]. Teknik-teknik ini telah dieksplorasi untuk aplikasi deteksi biomarker [ 102 , 103 ]. Keuntungan inheren dari teknik-teknik ini yang memungkinkan deteksi bebas label dengan sensitivitas tinggi menjadikannya alat yang menjanjikan untuk pemantauan proses berkelanjutan.
3.6 Teknik Baru Lainnya
Selain jenis teknik yang paling umum dibahas di atas, berbagai teknik lain telah dieksplorasi sebagai alat PAT untuk analisis protein secara real-time. Multi-angle light scattering (MALS), capillary electrophoresis dan teknik berbasis indeks bias adalah beberapa teknik yang baru-baru ini dieksplorasi.
MALS adalah teknik berbasis hamburan cahaya yang mengukur intensitas cahaya yang dihamburkan pada sudut hamburan yang berbeda dan menghubungkannya dengan berat molekul dan konsentrasi protein [ 104 ]. MALS telah digunakan secara teratur untuk karakterisasi protein [ 105 ]. Aplikasinya dalam analisis protein waktu nyata dieksplorasi dengan menggunakannya dalam pengaturan in-line selama pemurnian mAb untuk memantau agregasi protein, yang menghasilkan hasil waktu nyata dan kontrol umpan balik langsung [ 106 ]. Namun, ini adalah satu-satunya studi sejauh ini yang mengeksplorasi MALS sebagai alat PAT dalam pemrosesan hilir, dan studi lebih lanjut diperlukan untuk sepenuhnya memahami kemampuan teknik ini.
Elektroforesis kapiler, sebuah teknik pemisahan berdasarkan migrasi diferensial spesies bermuatan dalam medan listrik, telah banyak digunakan dalam industri biofarmasi untuk karakterisasi analitis. Namun, waktu pengukuran yang lebih lama telah menjadi hambatan bagi teknik tersebut untuk benar-benar dipertimbangkan untuk analisis waktu nyata [ 107 ]. Elektroforesis kapiler yang digabungkan dengan detektor UV diterapkan untuk memantau isoform mAb dalam eluen kolom CEX. Meskipun ini hanya dilakukan dalam pengaturan yang mirip dengan analisis at-line, metode ini menggunakan injeksi berurutan, yang sangat mengurangi waktu yang dibutuhkan untuk analisis. Dengan pendekatan yang dimodifikasi ini, ini mungkin merupakan teknik analitis potensial yang layak dieksplorasi untuk pengaturan PAT on-line dalam penelitian masa depan [ 108 ].
Harris et al. menggunakan sensor berdasarkan Indeks Refraksi (IoR) yang membentuk pengaturan in-line untuk mengukur konsentrasi protein secara real time selama langkah penangkapan dan ultrafiltrasi dari pemrosesan hilir. Sensor tersebut mampu mengukur konsentrasi protein secara akurat selama ultrafiltrasi dan selama langkah penangkapan [ 109 ]. Salah satu tantangan IoR adalah, sinyal dapat dipengaruhi oleh sifat fisikokimia cairan yang diukur, dan penelitian lebih lanjut diperlukan untuk memastikan efektivitas teknik ini sebagai alat PAT.
3.7 Kemometrika dan Kontrol Proses
Dalam produksi berkelanjutan, pemantauan atribut kualitas secara real-time sangat penting untuk mempertahankan kontrol proses dan memastikan konsistensi produk. Mencapai analisis real-time yang andal tidak hanya memerlukan pengukuran presisi tinggi tetapi juga interpretasi akurat dari data yang kompleks. Kemajuan terkini dalam teknologi analitis telah meningkatkan selektivitas dan sensitivitas berbagai teknik secara signifikan, namun memanfaatkan potensi ini bergantung pada interpretasi data yang tepat untuk memprediksi CPP dan CQA, yang penting untuk kontrol proses real-time dan jaminan kualitas. Hal ini telah menyebabkan penekanan yang semakin besar pada pemodelan statistik untuk mengekstrak wawasan yang bermakna dari kumpulan data ekstensif yang dihasilkan. Dengan integrasi pembelajaran mesin, ada potensi yang luar biasa untuk lebih mengoptimalkan pemanfaatan data, yang memungkinkan pengembangan model prediktif yang dapat secara akurat memperkirakan hasil kualitas atau parameter proses utama. Pergeseran ke arah analisis prediktif berbasis data ini menandai perubahan paradigma dalam pemantauan real-time, yang menjadikan analisis berkelanjutan sebagai realitas yang layak dan transformatif dalam manufaktur. Bidang kemometrika, yang menggabungkan pendekatan statistik dan kimia, mencakup upaya ini untuk interpretasi data dan analisis prediktif. Pada dasarnya, kemometrika melibatkan penerapan teknik pemodelan empiris multivariat pada data kimia [ 110 ].
Data mentah, terutama dari pengukuran spektroskopi memerlukan pra-pemrosesan data yang ekstensif seperti koreksi garis dasar dan penghalusan spektral [ 111 ]. Ini diikuti dengan penerapan teknik statistik tingkat lanjut. Analisis data multivariat memainkan peran penting dalam mengekstraksi wawasan yang bermakna dari kumpulan data kompleks yang dihasilkan dalam pemantauan proses. Teknik seperti Analisis Komponen Utama (PCA) diterapkan untuk pengurangan dimensionalitas, yang memfasilitasi interpretasi data berdimensi tinggi [ 110 ].
Terdapat penekanan yang semakin meningkat pada model berbasis data untuk memprediksi hasil yang berkualitas, yang memungkinkan pengendalian proses. Prinsip dasar dari model ini adalah bahwa model tersebut menggunakan fungsi matematika yang menghubungkan serangkaian prediktor (variabel independen) dengan respons (variabel dependen) yang dipelajari secara langsung dari data historis [ 112 ]. Model berbasis data sangat berguna karena model tersebut mengandalkan data historis untuk analisis prediktif, dan sangat sesuai jika parameter proses dan kualitas produk tidak dipahami dengan jelas [ 112 ].
Ada beberapa model berbasis data yang digunakan dalam pemodelan prediktif, dan yang umum termasuk regresi hutan acak (RFR), regresi kuadrat terkecil parsial (PLSR), regresi proses Gaussian (GPR), dan yang lebih baru, penggunaan jaringan saraf tiruan (ANN). Jaringan saraf konvolusional (CNN) adalah subtipe khusus dari ANN yang telah mendapatkan popularitas dan telah digunakan dalam bidang kemometrika [ 112 ]. Sering disebut sebagai ‘sensor lunak’, model ini digunakan untuk memprediksi CQA dan CPP berdasarkan korelasi dengan data yang dihasilkan. Mereka membentuk dasar untuk pemantauan waktu nyata dan dapat diintegrasikan dalam pengontrol untuk meningkatkan kontrol proses [ 113 ]. Hampir semua penelitian terbaru yang menggunakan alat PAT untuk pemantauan proses hilir (Tabel 1 ) telah menggunakan kemometrika secara ekstensif, menggunakan satu atau lebih model yang disebutkan di atas untuk memprediksi hasil kualitas, sehingga memungkinkan kontrol proses waktu nyata.
TABEL 1. Ringkasan literatur terkini (5 tahun terakhir) tentang penggunaan berbagai teknologi analitis untuk analisis real-time pada pemrosesan hilir protein.
Baru-baru ini, ada lebih banyak fokus pada pembuatan kembaran digital (DT), representasi virtual dan digital dari objek fisik atau proses. DT dapat dibuat untuk setiap unit operasi, memodelkan proses dalam mode virtual, yang memungkinkan prediksi waktu nyata dan kontrol proses. Misalnya, DT baru-baru ini dibuat untuk proses kromatografi pertukaran ion (IEX), dan terintegrasi secara sistematis dengan sistem HPLC dan komputer server. DT mampu memprediksi profil elusi, yang memungkinkan kontrol pengumpulan otomatis [ 114 ].
Semakin banyak penekanan pada integrasi sistem siber-fisik, di mana serangkaian teknik analitis akan dihubungkan ke alur kerja pemrosesan data otomatis, yang mengarah pada manajemen data yang efisien, visualisasi, dan pemanfaatan realitas tertambah untuk memungkinkan kontrol proses yang dinamis. Helgers et al. menunjukkan integrasi berbagai teknik spektroskopi, termasuk Raman, FTIR, spektroskopi fluoresensi, dan UV-Vis, dengan alur kerja data pemodelan prediktif dan DT untuk mencapai kontrol proses lanjutan (APC) [ 115 ].
Secara keseluruhan, integrasi berbagai teknik PAT in-line dan on-line ke aliran bioproses, dan sistem pemantauan proses (PMS) pada antarmuka analitis dan bioproses yang memungkinkan analisis dan visualisasi data otomatis, memungkinkan umpan balik atau kontrol umpan maju dari instrumen analitis dan proses, yang pada akhirnya menghasilkan kontrol proses yang dinamis dan dengan demikian memungkinkan pengujian pelepasan waktu nyata (RTRT) [ 40 ].
4 Ringkasan dan Prospek
Di sini kami mengulas teknik analitis yang muncul untuk implementasi dalam PAT dan memberikan perspektif tentang kemajuan terkini dalam alur kerja data dan otomatisasi yang merupakan pendorong utama dalam mewujudkan QbD dan RTRT. Meskipun kemajuan signifikan telah dibuat dalam teknologi analitis untuk meningkatkan hasil, sensitivitas, dan kecepatan pengukuran, setiap teknik memiliki kelebihan dan keterbatasannya sendiri.
Teknik spektroskopi telah banyak digunakan dalam PAT, karena sifatnya yang tidak merusak, persyaratan persiapan sampel minimal, dan kemudahan implementasi in-line atau on-line. Namun, teknik ini masih tertinggal dalam hal menawarkan spesifisitas tinggi, yang membutuhkan pemrosesan data yang berat dan canggih untuk mendapatkan wawasan yang berarti. Sebaliknya, kromatografi, dan teknik-tekniknya yang bersambung seperti spektrometri massa menawarkan spesifisitas yang diperlukan. Tantangan yang terkait dengan persiapan sampel yang ekstensif dan pra-pemrosesan telah diatasi melalui solusi pengambilan sampel otomatis. Lebih jauh lagi, kemajuan dalam instrumentasi kromatografi telah secara signifikan mengurangi waktu pengukuran. Namun, waktu pengukuran masih lebih lama untuk analitik real-time sejati dalam DSP, di mana waktu respons dalam beberapa detik hingga menit sangat penting. Selain itu, implementasi on-line menimbulkan tantangan, dan implementasi in-line saat ini sebagian besar masih tidak praktis.
Biosensor dapat mengisi celah yang sangat dibutuhkan, dengan menawarkan spesifisitas tinggi, sekaligus mudah diimplementasikan secara langsung maupun tidak langsung, serta memberikan pengukuran yang lebih cepat yang dibutuhkan untuk kontrol waktu nyata. Bila dilengkapi dengan ligan yang sesuai, biosensor memberikan spesifisitas yang dibutuhkan untuk mendeteksi tidak hanya analit target, tetapi juga pengotor lain yang terkait dengan produk atau proses, sehingga menjadikannya alat platform untuk memantau berbagai atribut. Akan tetapi, biosensor memerlukan ligan dengan afinitas tinggi terhadap analit target, yang terkadang dapat menimbulkan hambatan. Meskipun teknik berbasis biosensing tampak menjanjikan, studi yang menunjukkan penerapannya dalam pemantauan waktu nyata masih terbatas, yang menunjukkan perlunya penelitian lebih lanjut.
Kemajuan terus berkembang di bidang analitis, seperti peningkatan permukaan untuk metode spektroskopi [ 58 , 75 ] dan miniaturisasi kromatografi dan spektrometri massa [ 116 , 117 ]. Perkembangan ini menawarkan sensitivitas yang belum pernah terjadi sebelumnya dan memfasilitasi integrasi in-line dan on-line yang lebih mudah. Bahkan teknik yang dulunya dianggap tidak praktis untuk implementasi PAT, seperti kromatografi dan spektrometri massa telah menjadi alat PAT yang layak karena inovasi ini.
Setiap teknik analisis dalam kerangka PAT menawarkan kelebihan dan keterbatasan yang berbeda. Namun, kekuatan PAT terletak pada fleksibilitasnya untuk menggunakan teknik yang paling sesuai untuk memantau atribut kualitas tertentu berdasarkan persyaratan proses. Penekanannya harus melampaui teknik individual untuk mengoptimalkan integrasi dan pemanfaatan data yang diperoleh secara efektif. Pemodelan prediktif memainkan peran penting dalam memperoleh wawasan yang dapat ditindaklanjuti untuk pengendalian proses yang efektif. Peningkatan dalam otomatisasi data, alur kerja yang efisien, pembentukan jalur data yang menghubungkan sistem perusahaan dan pemodelan prediktif, dikombinasikan dengan DT, memiliki potensi untuk mewujudkan visi pemantauan proses waktu nyata dan rilis produk waktu nyata.
Untuk sepenuhnya menerapkan Quality by Design dalam kerangka kerja produksi berkelanjutan, alur kerja PAT yang komprehensif harus melampaui otomatisasi pengujian dan analisis dengan hasil tinggi. Penekanan yang sama harus diberikan pada pengembangan sistem siber-fisik multi-lapis yang tangguh dengan strategi mitigasi risiko yang efektif untuk memungkinkan manajemen data yang efisien, visualisasi waktu nyata, realitas tertambah, dan infrastruktur Internet of Things (IoT). Bersama-sama, kemajuan ini akan memfasilitasi analisis waktu nyata dan kontrol proses, yang membawa industri biomanufaktur lebih dekat untuk mewujudkan proses manufaktur yang sepenuhnya terintegrasi dan cerdas.
Meskipun secara luas diakui bahwa kerangka kerja PAT yang selaras dengan pendekatan QbD diperlukan untuk mencapai manufaktur berkelanjutan, kontrol proses, dan RTR) [ 40 ], masih ada beberapa keraguan untuk mengimplementasikan PAT dalam skala komersial. Keengganan ini sebagian besar disebabkan oleh meningkatnya beban pengajuan peraturan. Dengan semakin bergantungnya pada model prediktif untuk kontrol proses, sangat penting untuk memvalidasi model ini dan menyediakan dokumentasi yang ketat. Ini termasuk menunjukkan keterbandingannya, keandalannya, dan justifikasinya untuk parameter yang digunakan selama pengembangan model. Selain itu, keterbandingan data analitis rutin dengan data yang dihasilkan PAT harus ditetapkan [ 118 ].
Meskipun demikian, FDA telah secara aktif mendorong industri untuk mengadopsi PAT dan beralih ke pendekatan QbD. Sejak diperkenalkannya PAT pada tahun 2004 [ 18 ], berbagai upaya signifikan telah dilakukan untuk mendukung industri dalam transisi ini. Untuk lebih mendukung inisiatif ini, FDA membentuk ‘Tim Teknologi Baru’ (ETT), yang bekerja sama dengan industri farmasi untuk memberikan penilaian awal dan panduan selama pengajuan regulasi untuk PAT, memastikan proses peninjauan yang lebih lancar [ 119 ].
Industri biofarmasi tengah mengalami perubahan paradigma dalam bidang manufaktur, analisis, dan pengendalian mutu. Meskipun penekanan signifikan diberikan pada pengembangan instrumentasi analisis dan pengoptimalan alur kerja data, fokus pada penerapan kemajuan ini dalam skala komersial juga sama pentingnya. Kolaborasi terbuka antara otoritas regulasi dan profesional industri sangat penting untuk mewujudkan visi penerapan QbD yang efektif, mendorong inovasi sekaligus memastikan kepatuhan dan mutu produk.

