
Abstrak
Transportasi ionik yang tidak memadai melintasi antarmuka elektroda/elektrolit menghambat kinetika reaksi litium-sulfur, sehingga membatasi kinerja elektrokimia baterai litium-sulfur serba-padat (ASSLSB). Di sini, lapisan modulator gradien yang ditingkatkan secara kinetik (KEGML) diusulkan dan dibuat melalui modulasi potensial. Analisis in situ/ex situ mengungkapkan perbedaan potensial termodulasi optimal yang mendorong reaksi kimia antara ion Li dan produk pra-antarfase P 2 S 5 untuk KEGML yang stabil dan konversi sulfur penuh yang dipertahankan. Karakterisasi mikroskop elektron pemindaian berkas ion yang terfokus pada krio dan dinamika molekuler ab-initio mengonfirmasi penguatan antarmuka dengan penyeragaman gradien transportasi ion dan peningkatan stabilitas antarmuka dengan secara efisien menghindari efek samping antara elektrolit padat/karbon sulfur/sulfida. Hasilnya, peningkatan delapan kali lipat dalam kemampuan transportasi ionik dicapai dengan KEGML pada akhir 200 siklus. Yang mengesankan, ASSLSB berbasis KEGML tidak hanya mempercepat konversi redoks tetapi juga menampilkan stabilitas siklus yang luar biasa dengan kapasitas spesifik 1578,9 mAh g −1 selama ≈1,5 tahun dengan retensi kapasitas 99,9% dan kapasitas areal tinggi 13 mAh cm −2 selama 200 siklus, yang termasuk dalam level rekor. Bahkan dalam lingkungan sekitar dari 60 °C hingga serendah −30 °C, ia menunjukkan adaptabilitas yang sangat baik yang dikaitkan dengan kinetika cepat, yang menjelaskan aplikasi praktis di masa mendatang.
1 Pendahuluan
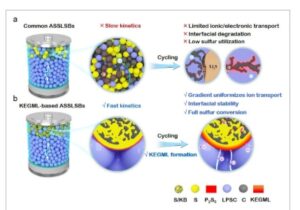
Teknologi baterai lithium-sulfur serba-padat (ASSLSB) telah dieksplorasi tidak hanya untuk meningkatkan keamanan secara signifikan dengan menghilangkan komponen cairan yang mudah terbakar tetapi juga untuk mengatasi masalah pelarutan lithium polisulfida. [ 1 – 7 ] Eksplorasi ini berpotensi membuka ASSLSB sebagai teknologi penyimpanan energi masa depan yang utama, dengan kapasitas spesifik teoritis yang tinggi sebesar 1675 mAh g −1 . [ 4 , 5 ] Baru-baru ini, elektrolit keadaan padat sulfida (SSE) telah diselidiki secara ekstensif karena konduktivitas ionik suhu kamar yang luar biasa (10 −2 S cm −1 ), modulus Young sedang (10–20 GPa), dan kompatibilitas yang sangat baik dengan senyawa sulfida. [ 8 , 9 ] Meskipun demikian, transportasi elektronik dan ionik yang lambat terutama disebabkan oleh buruknya keterbasahan partikel-partikel semua-padatan pada antarmuka tiga komponen yang terbentuk di antara sulfur aktif, SSE sulfida penghantar ion, dan konduktor elektronik karbon sangat membatasi pemanfaatan sulfur seperti yang digambarkan pada Gambar 1 a , sehingga menghasilkan efisiensi Coulombik (CE) yang rendah dan penurunan kapasitas selama siklus jangka panjang. [ 10 , 11 ] Meskipun saat ini penelitian tentang antarmuka antara sulfur/sulfida dan SSE sulfida masih terbatas, perhitungan teoritis memperkirakan bahwa kemungkinan konsumsi timbal balik antarmuka dapat mengakibatkan kinetika reaksi yang lambat dan stabilitas siklus yang buruk. [ 12 , 13 ]
Gambar 1
Buka di penampil gambar
Presentasi PowerPoint
Ilustrasi skema a) ASSLSB umum dan b) ASSLSB berbasis KEGML.
Upaya telah dilakukan untuk meningkatkan transportasi ionik/elektronik pada antarmuka tiga komponen, [ 14 – 25 ] tetapi mereka jarang mempertimbangkan masalah dekomposisi antarmuka yang disebabkan oleh reaksi samping dan kontak yang tak terelakkan dengan SSE sulfida secara simultan. [ 26 , 27 ] Selain itu, penelitian semakin banyak menggunakan sulfida logam transisi sebagai host sulfur dan bahan aktif, memperkenalkan katalis, dan menggunakan larutan padat (misalnya, Li 2 S-LiI dan Li 2 S-Li 2 O-LiI). [ 28 – 37 ] Metode-metode ini bertujuan untuk mengurangi area kontak antara antarmuka karbon dan SSE sulfida dan meningkatkan transportasi ion di sekitar sulfur. [ 28 – 37 ] Meskipun demikian, hasil penelitian ini masih memiliki keterbatasan dalam hal kapasitas teoritis (<1200 mAh g −1 ) atau siklus hidup. [ 28 , 29 , 31 – 37 ] Selain itu, potensi ketidakstabilan SSE sulfida di bawah jendela potensial yang diterapkan secara luas masih belum diselidiki secara memadai. Karena kinetika reaksi yang lambat dari reaksi kimia solid-state, ASSLSB memerlukan rentang potensial yang lebih luas dibandingkan dengan baterai Li-S liquid-state untuk konversi sulfur penuh. [ 38 ] Namun, rentang stabilitas elektrokimia SSE sulfida relatif sempit. [ 12 , 38 , 39 ] Produk degradasi, seperti P 2 S 5 , Li 3 P, dan Li 2 S, meningkatkan kompleksitas produk pelepasan, [ 40 ] menghambat transpor elektron/ion dan selanjutnya memperburuk kinerja baterai. [ 38 ] Penelitian Janek et al. menunjukkan bahwa transpor ion yang efektif dapat terjadi dalam rentang potensial yang lebih luas untuk meningkatkan kapasitas ASSLSB yang dapat dicapai tanpa mengorbankan transpor ionik keseluruhan. [ 38 ] Dengan kata lain, kemungkinan memberikan dorongan potensial yang lebih besar untuk mencapai konversi sulfur lengkap tanpa mempengaruhi transportasi ion litium secara signifikan.
Sampai saat ini, tidak ada konsensus mengenai rentang potensial yang diterapkan untuk ASSLSB berbasis SSE sulfida. Berbagai rentang potensial telah dilaporkan, seperti 0,8–2,4 dan 1,5–3,0 V versus Li + /Li, 0,7–2,7 dan 0,5–3,0 V versus Li + /Li-In dalam ASSLSB menggunakan katode komposit S/C dan LPSC sebagai SSE. [ 16 , 18 , 41 , 42 ] Jujur saja, para peneliti ini belum memberikan penjelasan terperinci untuk pilihan mereka atau dampak potensial dari kemungkinan dekomposisi LPSC dalam rentang spesifik ini. Awalnya, Janek et al. melaporkan bahwa potensial cut-off muatan yang lebih tinggi menghasilkan kapasitas redoks reversibel yang lebih tinggi tetapi menghambat transpor ion dan meningkatkan overpotensial katode (degradasi oksidatif). [ 38 , 39 ] Potensial batas pelepasan yang lebih rendah telah ditemukan secara bertahap mengarah ke antarmuka tiga komponen yang tidak stabil, peningkatan impedansi antarmuka, dan penurunan kinerja siklus baterai (degradasi reduktif). [ 38 , 39 ] Mereka selanjutnya menyelidiki stabilitas jangka panjang dengan berbagai rentang potensial siklus dan menemukan bahwa peningkatan potensi batas pelepasan membatasi konversi sulfur tetapi meningkatkan kinerja siklus dan daya tahan jangka panjang. [ 39 ] Kecuali laporan Kim et. al., [ 30 ] masih ada penelitian terbatas tentang korelasi kompleks antara rentang potensial yang diterapkan, yang menghasilkan produk antarmuka dan pelepasan, dan kinerja elektrokimianya. Namun, stabilitas 1500 siklus ini dicapai dengan mengorbankan konversi padat-padat yang terbatas dari S ke Li 2 S untuk mempromosikan produk pelepasan yang dominan Li 2 S 2 . [ 30 ] Reaksi lambat Li 2 S ke S dianggap sebagai hambatan untuk siklus jangka panjang. [ 38 ] Oleh karena itu, modulasi dan pemanfaatan potensial pemotongan pelepasan yang tepat untuk memungkinkan kinetika reaksi cepat dan membentuk antarmuka yang stabil sangat penting untuk katoda sulfur karena hal ini secara langsung mempengaruhi konversi sulfur lengkap dan memastikan umur yang panjang.
Di sini, modulasi potensial yang diterapkan telah diselidiki untuk mengendalikan lapisan modulator gradien yang ditingkatkan secara kinetik (KEGML) (Gambar 1b ). KEGML diterapkan pada permukaan partikel karbon/sulfur untuk meningkatkan kinerja antarmuka katode sulfur. Ini dapat menghambat dekomposisi LPSC dan meningkatkan stabilitas antarmuka dengan menghalangi kontak langsung antara karbon dan LPSC. Lebih jauh lagi, ini tidak hanya berfungsi sebagai lapisan penghantar ion untuk memfasilitasi transportasi ion Li + tetapi juga bertindak sebagai lapisan modulator gradien untuk meningkatkan kontak antarmuka. Secara rinci, pra-reaksi antarmuka terjadi antara sejumlah kecil fosfor (P) dan S untuk membentuk P 2 S 5 pada komposit S/KB (S/KB@P), diikuti oleh modulasi potensial cut-off pelepasan awal untuk memfasilitasi reaksi antara pra-antarfase P 2 S 5 dan ion Li + , secara bertahap membentuk KEGML dalam ASSLSB. Rentang potensial yang diterapkan berbeda menghasilkan konsentrasi ion Li + yang berbeda yang bereaksi dengan pra -interfase P2S5 , yang mengarah ke keadaan kimia KEGML yang berbeda. Sifat struktural dan kimia KEGML selama modulasi potensial dinamis diselidiki oleh mikroskop elektron pemindaian berkas ion yang terfokus pada krio ( Cryo-FIB-SEM), dan analisis Raman in situ. Dikombinasikan dengan kemampuan transpor ionik selama 200 siklus, analisis distribusi Waktu Relaksasi (DRT) dari evolusi impedansi antarmuka, dan ab-ke dalam dinamika molekuler (AIMD), ASSLSB berbasis KEGML menunjukkan potensi besar dalam meningkatkan transpor ion Li + dan menstabilkan antarmuka tiga komponen, yang mengarah ke konversi kimia keadaan padat sulfur lengkap secara simultan serta stabilitas siklus yang sangat panjang.
2 Hasil dan Pembahasan
2.1 Karakterisasi dan Pembentukan KEGML
Kandungan S dalam komposit S/KB adalah 65% (Gambar S1 , Informasi Pendukung). Pemuatan dengan S menyebabkan penurunan signifikan dalam luas permukaan spesifik dan menghilangkan puncak penting dalam distribusi ukuran pori, yang menunjukkan pengendapan sulfur baik pada permukaan luar maupun dalam pori-pori partikel KB (Gambar S2 , Informasi Pendukung). [ 43 ] Tidak ada perubahan nyata dalam morfologi komposit S/KB@P sebelum dan setelah peracikan P (Gambar S3 , Informasi Pendukung). Gambar TEM mengungkapkan morfologi bola tidak teratur dengan diameter partikel tunggal 50–100 nm (Gambar S4 , Informasi Pendukung). Gambar S5 dan S6 (Informasi Pendukung) mengungkapkan distribusi homogen elemen S dan P. Tidak ada puncak yang sesuai dengan S kristal yang diamati, yang merupakan fenomena umum menggunakan pengendapan uap (Gambar S7a , Informasi Pendukung). [ 43 , 44 ] Selain itu, tidak adanya puncak yang dikaitkan dengan P dalam S/KB@P selaras dengan sifatnya yang amorf dan kandungannya yang rendah. Setelah membandingkan spektrum XPS komposit S/KB@P (Gambar S7b,c , Informasi Pendukung) dengan P 2 S 5 komersial (Gambar S8 dan Tabel S1 , Informasi Pendukung), ditemukan bahwa produk pra-reaktan antara S dan P pada permukaan partikel S/KB adalah P 2 S 5 . Puncak karakteristik P 2 S 5 juga dapat dideteksi dalam spektrum Raman, yang mengonfirmasi pembentukan P 2 S 5 setelah pra-reaksi antara S dan P selama ball-milling jangka panjang (Gambar S9a , Informasi Pendukung). Lebih jauh lagi, ketebalan lapisan P 2 S 5 adalah ≈8 nm dalam komposit S/KB@P, yang dibuktikan dengan melakukan analisis XPS Mendalam (Gambar S9b , Informasi Pendukung).
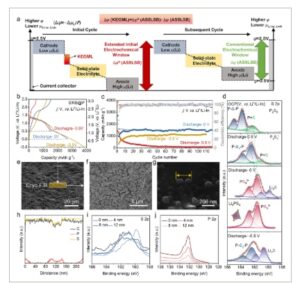
Di bawah rentang potensial yang dioperasikan secara umum sebesar 0,5–2,5 V versus Li + /Li-In, [ 25 , 43 , 45 – 48 ] kapasitas pelepasan awal katode S/KB adalah 1489 mAh g −1 dan menurun menjadi 656 mAh g −1 setelah 100 siklus (Gambar S10 , Informasi Pendukung). Untuk memperjelas keadaan kimia elektroda, puncak yang terkait dengan S dan Li x S diamati dalam spektrum S 2p setelah 10 siklus (Gambar S11 dan Tabel S2 , Informasi Pendukung). [ 39 ] Gambar S12 (Informasi Pendukung) menunjukkan spektrum S 2p XPS dari Li 2 S komersial, elektrolit solid-state Li 6 PS 5 Cl (LPSC), dan sampel LPSC setelah siklus sebagai referensi. Kinerja elektrokimia yang buruk dapat dikaitkan dengan kinetika reaksi yang lambat, yang menyebabkan konversi S yang tidak lengkap dan dekomposisi LPSC parsial. [ 38 – 40 ] Dalam hal ini, KEGML termodulasi potensial yang unik dapat secara efektif memecahkan masalah yang disebutkan di atas. Melalui perluasan potensial batas pelepasan awal, pra-interfase P 2 S 5 pada S/KB mengalami reaksi dengan ion Li + , yang menghasilkan pembentukan KEGML. Jendela elektrokimia awal ASSLSB diperluas oleh jendela elektrokimia yang disediakan oleh KEGML ( Gambar 2 a ). Jendela elektrokimia konvensional (0,5–2,5 V vs Li + /Li-In) diadopsi dalam siklus berikutnya untuk memastikan keberadaan KEGML. Jendela elektrokimia efektif KEGML adalah jendela elektrokimia yang diperluas yang mengurangi jendela elektrokimia konvensional (Δ φ (KEGML)), yang menentukan konsentrasi ion yang terlibat dalam reaksi antarmuka dan keadaan kimia KEGML. Dampak dari berbagai keadaan kimia KEGML pada kinerja baterai diselidiki lebih lanjut dengan mengatur Δ φ (KEGML). Kinerja elektrokimia katode S/KB@P dioptimalkan pada potensi batas pelepasan awal 0 V vs Li + /Li-In (Gambar 2b,c ), mencapai siklus stabil pada kapasitas spesifik 1579 mAh g −1 dalam jendela potensial berikutnya 0,5–2,5 V versus Li + /Li-In. Namun, ketika awalnya dilepaskan ke −0,5 V versus Li + /Li-In, siklus stabil diamati tetapi dengan penurunan kapasitas pelepasan.
Gambar 2
Buka di penampil gambar
Presentasi PowerPoint
a) Diagram skema jendela elektrokimia yang diterapkan (batang warna) untuk operasi ASSLSB berbasis KEGML. Variabel μ dan φ masing-masing adalah potensial kimia dan potensial listrik. Simbol F mewakili gaya listrik, yang digunakan untuk menjelaskan hubungan antara muatan listrik dan perbedaan potensial. b) Profil muatan-pelepasan dan c) kinerja siklik katode S/KB@P dengan muatan aktif 1 mg cm −2 pada 0,1C di bawah potensial batas pelepasan yang berbeda, dan d) Spektrum S 2p XPS katode S/KB@P-LiI pada potensial batas pelepasan yang sesuai. e–g) Gambar Cryo-FIB-SEM. h) Pemindaian garis SEM-EDX P, S, dan C dalam garis yang divisualisasikan dalam 2g. i) S 2p, dan j) P 2p spektrum profil mendalam XPS dari katode S/KB@P-LiI yang dikosongkan ke 0 V versus Li + /Li-In.
Hayashi et al. [ 34 ] menunjukkan bahwa penyelidikan mekanisme reaksi Li 2 S/S dalam katode Li 2 S-LiI-C dimungkinkan dengan menggunakan LiI yang sangat kristalin sebagai konduktor ionik untuk analisis XPS guna menghindari interferensi komposisi kimia yang sama (S dan LPSC). Mengikuti pendekatan ini, katode S/KB@P-LiI disiapkan tanpa LPSC untuk analisis yang lebih rinci. Eksperimen voltametri siklik (CV) pada siklus awal pertama kali dilakukan untuk menyelidiki evolusi komposisi katode S/KB@P selama (dis)charging. Seperti yang ditunjukkan pada kurva CV (Gambar S13a , Informasi Pendukung), katode keduanya menunjukkan satu pasang puncak reduksi dan oksidasi yang lebar ≈1,0 dan 2,0 V versus Li + /Li-In yang terkait dengan konversi keadaan padat S. Perbedaan utama di antara keduanya adalah bahwa satu puncak lebar setelah 0,5 V versus Li + /Li-In dalam sapuan katode awal katode S/KB@P, yang mungkin disebabkan oleh reaksi lithiasi senyawa P 2 S 5 yang terbentuk pada S/KB@P. Kurva CV katode S/KB@P selama siklus awal dengan potensial batas yang lebih rendah diterapkan (Gambar S13b , Informasi Pendukung). Puncak lebar diamati dalam rentang tegangan 0,5 hingga −0,5 V versus Li + /Li-In. Reaksi konversi ini dan produk yang sesuai dapat diidentifikasi dengan analisis XPS ex situ yang ditunjukkan pada Gambar 2d . Gambar S14 (Informasi Pendukung) menunjukkan bahwa LiI bukan pusat redoks primer. [ 34 ] Spektrum XPS S 2p (Gambar 2d ) dan P 2p (Gambar S15a , Informasi Pendukung) dari katode S/KB@P-LiI pada potensial rangkaian terbuka (OCP) (Tabel S3 , Informasi Pendukung) menunjukkan keadaan kimia yang sesuai dengan spektrum P 2 S 5 . Setelah pelepasan ke 0,5 V versus Li + /Li-In, puncak hijau dan puncak biru secara bertahap bergabung, dengan intensitasnya berkurang secara bersamaan, menunjukkan proses lithiasi yang dimulai terjadi pada P 2 S 5 . Setelah pelepasan ke 0 V versus Li + /Li-In, dua puncak doublet bergabung dan bergeser ke 162,8 dan 161,6 eV, masing-masing. Lokasi dan profil puncak menjadi hampir identik dengan spesies PS 4 − dalam bubuk Li 3 PS 4 komersial . Pada saat yang sama, puncak doublet pada 161,0 dan 159,8 eV (area berbayang ungu) sesuai dengan spektrum S 2p dari bubuk Li 2 S komersial (GambarS12a , Informasi Pendukung). Setelah pengosongan ke -0,5 V versus Li + /Li-In, lokasi puncak tersebut bergeser secara signifikan ke energi pengikatan yang lebih tinggi, yang menunjukkan hilangnya Li 3 PS 4 . Hasil ini menunjukkan bahwa proses termodulasi potensial menghasilkan pembelahan ikatan P═S dan P─S─P dalam P 2 S 5 dan menghasilkan Li 3 PS 4 dan Li 2 S pada permukaan antara rentang potensial 0,5–0 V versus Li + /Li-In. Untuk mengonfirmasi hal ini lebih lanjut, katode dengan hanya P 2 S 5 dan LiI yang ditandai sebagai katode KB-P 2 S 5 -LiI disiapkan dan dikenai kondisi pengosongan yang sama, diikuti oleh pengukuran XPS yang ditunjukkan pada Gambar S16 dan Tabel S4 (Informasi Pendukung). [ 49 , 50 ] Hasil analisis XPS lebih lanjut menunjukkan bahwa berbagai keadaan kimia KEGML yang dimodulasi potensial konsisten dengan keadaan kimia KEGML selama proses pertumbuhannya pada katoda S/KB@P.
Selanjutnya, cryo-FIB-SEM digunakan untuk mempertahankan integritas kimia katode S/KB@P-LiI yang dilepaskan ke 0 V versus Li + /Li-In (Gambar 2e ). [ 51 , 52 ] Gambar 2f mengilustrasikan penampang partikel komposit dalam kontak padat-padat dalam bidang katode yang dipotong. Garis pada penampang yang diperoleh melalui perlakuan cryo-FIB pada partikel komposit individual (Gambar 2g ) dianalisis menggunakan EDX. Komponen P pada permukaan komposit tunggal menunjukkan variasi bertahap di sepanjang tepinya dan penurunan progresif dalam konsentrasi berbasis fosfat dari permukaan luarnya ke arah interiornya (Gambar 2h ). Profil XPS yang mendalam menunjukkan penurunan yang signifikan dalam intensitas puncak S 2p yang terkait dengan PS 4 3− sementara peningkatan diamati pada puncak yang terkait dengan Li 2 S saat kedalaman etsa meningkat (Gambar 2i ). Penurunan yang luar biasa pada puncak P 2p dikaitkan dengan PS 4 3− setelah pengetsaan (Gambar 2j ). Selain itu, modulator gradien menunjukkan transisi yang halus dalam komposisi P dan S (Gambar S17a,b , Informasi Pendukung). Temuan ini mengonfirmasi gradien radial. Selain itu, persistensi gradien yang diharapkan dikonfirmasi lebih lanjut melalui spektrum XPS yang mendalam setelah siklus yang diperpanjang (Gambar S15b,c , Informasi Pendukung). Stabilitas gradien jangka panjang ini mungkin merupakan faktor kunci yang berkontribusi pada kinerja tinggi. Gambar S17c,d (Informasi Pendukung) mengonfirmasi keberadaan KEGML pada antarmuka kontak dalam sekelompok partikel. KEGML yang dimodulasi potensial memastikan distribusi yang homogen di seluruh material katode, memfasilitasi akses mudah untuk aktivasi dan interaksi Li + dalam S internal antarmuka.
2.2 Kinerja Elektrokimia ASSLSB Berbasis KEGML
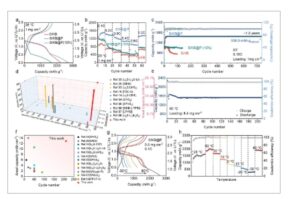
Pengenalan jumlah P yang lebih tinggi (hingga 10%) dalam proses pra-reaksi menghasilkan peningkatan overpotensial pada profil tegangan pengisian/pengosongannya ( Gambar 3 a ). Spektrum XPS P 2p dari katode S/KB@P(10%) pada Gambar S18a (Informasi Pendukung) tidak hanya menunjukkan puncak yang sesuai dengan P 2 S 5 tetapi juga puncak yang menunjukkan P. Ini menunjukkan bahwa jumlah P yang ditambahkan berlebihan; keberadaan P yang tidak bereaksi dengan isolasi ion dan elektron akan menghasilkan peningkatan resistansi ionik/elektronik (Gambar S18b,c , Informasi Pendukung), yang mengarah pada peningkatan overpotensial. Sementara katode S/KB tanpa P tidak menunjukkan overpotensial yang besar (Gambar 3a ), ia mengalami kapasitas rendah dan pemudaran kapasitas yang cepat (Gambar 3b,c ). Meskipun kemampuan laju katode S/KB@P(10%) sedikit lebih baik daripada katode S/KB, tetapi secara signifikan lebih rendah daripada katode S/KB@P. Katode S/KB@P(10%) menunjukkan kapasitas rendah sebesar 895,1 mAh g −1 tetapi retensi kapasitas yang sangat baik (Gambar 3c ). Berdasarkan evaluasi komprehensif dari sifat elektrokimia yang disajikan di atas, kandungan P optimum dalam katode S/KB@P ditetapkan sebesar 4%. Katode S/KB@P menunjukkan stabilitas siklus sangat panjang yang luar biasa (≈1,5 tahun), mempertahankan 99,9% dari kapasitasnya dan mempertahankan kapasitas reversibel tinggi sebesar 1579 mAh g −1 setinggi 558,3 mAh g −1 berdasarkan berat total katode. Pengukuran XPS dilakukan untuk menyelidiki lebih lanjut alasan kegagalan katode S/KB. Ditemukan bahwa lokasi puncak yang terkait dengan LPSC berubah selama siklus, dan terdapat konversi S yang tidak lengkap (Gambar S19a,b dan Tabel S5 , Informasi Pendukung). Sebagai perbandingan, tidak ada puncak karakteristik yang terkait dengan konversi Li 2 S yang tidak lengkap atau dekomposisi LPSC dalam spektrum S 2p katode S/KB@P, yang menunjukkan bahwa KEGML mendorong kinetika reaksi untuk konversi sulfur penuh dan meningkatkan stabilitas.
Gambar 3
Buka di penampil gambar
Presentasi PowerPoint
a) Profil tegangan awal pelepasan-pengisian pada 0,1C, b) Kemampuan laju, dan c) kinerja siklus katode S/KB, S/KB@P, dan S/KB@P(10%). d) Perbandingan kinerja dan kapasitas siklus. e) Kinerja siklus pada 0,1C dengan pembebanan aktif sebesar 8,4 mg cm −2 . f) Perbandingan kinerja siklus dan kapasitas areal. g,h) Kinerja elektrokimia pada 0,1C dari ASSLSB berbasis Li3PS4-KEGML pada suhu yang berbeda .
Untuk mengungkap lebih jauh kinetika reaksi yang ditingkatkan, uji CV pada laju pemindaian yang berbeda dari 0,1 hingga 1,0 mV s −1 dilakukan untuk menentukan koefisien difusi ion Li. Seperti yang ditunjukkan pada Gambar S20 (Informasi Pendukung), katode S/KB@P menunjukkan intensitas arus yang lebih tinggi dan kelebihan potensial yang lebih rendah daripada katode S/KB, yang menunjukkan bahwa KEGML dapat meningkatkan transportasi Li + dan kinetika reaksi. Selain itu, kemiringan katoda dan kemiringan anoda S/KB@P masing-masing adalah 1,91 dan 1,74, yang lebih tinggi daripada puncak reduksi S/KB 0,62 dan puncak oksidasi 0,49, yang menunjukkan bahwa KEGML berbasis Li3PS4 dapat meningkatkan transportasi Li + untuk redoks dari koefisien difusi Li + yang diperkirakan . Dua kesimpulan penting dapat diambil dari hasil di atas: 1) Pembentukan Li3PS4 – KEGML memfasilitasi transportasi ion dalam partikel elektroda komposit, meningkatkan penggunaan S dan mendorong kinetika reaksi cepat di katode. 2) Li3PS4 – KEGML meningkatkan stabilitas sekaligus mengurangi dekomposisi LPSC. Hasilnya, katode S/KB@P menunjukkan kapasitas spesifik tertinggi (berdasarkan berat katode total) pada suhu ruangan, sekaligus menunjukkan siklus hidup yang luar biasa (Gambar 3d ). [ 14 , 18 , 20 , 33 , 53 – 58 ]
Setelah 1000 siklus pada 2C, kapasitas spesifik sebesar 454,3 mAh g −1 dipertahankan, yang menyiratkan tingkat retensi kapasitas sebesar 69% (Gambar S21 , Informasi Pendukung). Bahkan dalam kondisi pembebanan tinggi, keberadaan Li 3 PS 4 -KEGML mempertahankannya pada 1524 mAh g −1 setelah 210 siklus dengan pembebanan 8,4 mg cm −2 (Gambar S22a , Informasi Pendukung; Gambar 3e ). Kapasitas areal maksimum yang dicapai adalah 13,0 mAh cm −2 . Dengan pembebanan maksimum 10,2 mg cm −2 , kapasitas areal pelepasan mencapai 7,1 mAh cm −2 (Gambar S22b,c , Informasi Pendukung). Ini menunjukkan kapasitas areal tertinggi di antara semua katode yang dilaporkan setelah lebih dari 200 siklus (Gambar 3f ). [ 14 , 20 , 30 , 33 , 43 , 53 – 55 , 58 – 61 ] Kemampuan laju katode S/KB@P pada berbagai suhu menunjukkan kapasitas pelepasan sebesar 310 mA hg −1 dengan CE sebesar 99,4% pada suhu −30 °C, masing-masing (Gambar 3g,h ). Ketika suhu kembali ke 60 °C, kapasitas pelepasan yang dapat diisi ulang kembali ke 1902 mA hg −1 dengan CE sebesar 99,4%, yang menunjukkan ketahanan substansial terhadap fluktuasi suhu. Lebih jauh lagi, kapasitas retensi ASSLSB berbasis KEGML hingga 100 siklus pada suhu −30 dan 60 °C menunjukkan stabilitas siklus yang luar biasa (Gambar S23a,b , Informasi Pendukung). Pada saat yang sama, penurunan bertahap dalam konsentrasi P dengan meningkatnya kedalaman etsa menunjukkan bahwa gradien KEGML tetap stabil pada suhu -30 dan 60 °C (Gambar S23c,d , Informasi Pendukung). Temuan ini menunjukkan stabilitas struktural dan jangka panjang ASSLSB yang mendukung KEGML dalam kondisi suhu yang luas.
2.3 Mekanisme Reaksi Kopling pada ASSLSB Berbasis KEGML
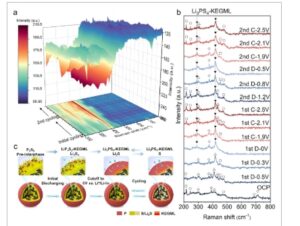
Raman in situ dilakukan untuk menyelidiki mekanisme reaksi elektrokimia kopling dari ASSLSB berbasis KEGML ( Gambar 4 a ; Gambar S24 , Informasi Pendukung). Spektrum Raman disajikan untuk analisis terperinci dari proses pembentukan KEGML (Gambar 4b ; Gambar S25 , Informasi Pendukung). Gambar S26a (Informasi Pendukung) menunjukkan spektrum Raman dari S komersial dan Li 3 PS 4 sebagai referensi. Awalnya, komposit S/KB@P menunjukkan puncak lebar pada 471, 245, dan 217 cm −1 yang dikaitkan dengan ikatan S─S dalam S, bersama dengan puncak pada 390 cm −1 yang dikaitkan dengan ikatan PSP. [ 45 , 46 ] Sementara itu, getaran peregangan ikatan P═S diamati pada ≈686 dan 712 cm −1 . [ 45 , 46 , 62 ] Sidik jari Raman dari P 2 S 5 diamati pada 390, 686, dan 712 cm −1 , yang sesuai dengan mode T2 dan A1. [ 62 ] Posisi puncak dalam bilangan gelombang ini konsisten dengan tunggal Raman P 2 S 5 komersial pada Gambar S26b (Informasi Pendukung). Selama proses pelepasan awal, ikatan P═S menghilang dan ikatan P─S─P terbagi menjadi ikatan P─S pada 370 dan 410 cm −1 . [ 45 , 46 , 49 ] Puncak pada 410 cm −1 secara bertahap bergeser ke atas hingga 420 cm −1 pada 0 V versus Li + /Li-In, disertai dengan munculnya puncak baru pada 290 cm −1 , yang menunjukkan pembentukan Li 3 PS 4 -KEGML. [ 49 ] Hasil ini konsisten dengan spektrum XPS pada Gambar 2d . Selama pembentukan KEGML, puncak yang terkait dengan Li 2 S x diamati pada 451 cm −1 , [ 63 ] yang menghilang saat pelepasan berakhir. Secara bersamaan, puncak yang terkait dengan ikatan Li-S dari Li 2 S terlihat pada 375 cm −1 yang konsisten dengan bilangan gelombang posisi puncak dari tunggal Li 2 S pada Gambar S26b (Informasi Pendukung), [ 64 ]menunjukkan transformasi fase antara Li 2 S x diikuti oleh konversinya menjadi Li 2 S, bersamaan dengan konversi S/Li 2 S. Perlu dicatat bahwa Li 3 PS 4 -KEGML tetap terlihat dalam siklus berikutnya di bawah jendela potensial 0,5–2,5 V versus Li + /Li-In, sementara reaksi konversi reversibel antara S dan Li 2 S berlangsung. Mekanisme siklus elektrokimia dirangkum dalam Gambar 4c . Melalui perluasan potensial batas pelepasan awal, pra-interfase P 2 S 5 pada S/KB mengalami reaksi dengan ion Li, yang menghasilkan pembentukan KEGML. Secara rinci, pra-interfase P 2 S 5 bertransformasi dengan ion Li menjadi Li 3 PS 4 -KEGML di sepanjang radius permukaan partikel komposit pada potensial pelepasan 0 V versus Li + /Li-In. Jendela elektrokimia awal ASSLSB diperluas oleh jendela elektrokimia yang disediakan oleh KEGML (Gambar 2a ). Kemudian, jendela elektrokimia konvensional yang lebih sempit (0,5–2,5 V vs Li + /Li-In) diadopsi dalam siklus berikutnya untuk memastikan keberadaan KEGML. Mirip dengan proses pra-lithiation, sebagian ion Li disimpan melalui reaksi dengan antarmuka awal P 2 S 5 selama siklus pelepasan awal. Oleh karena itu, Li 3 PS 4 -KEGML menunjukkan stabilitas, memfasilitasi transportasi ionik dalam partikel katode S/KB selama siklus yang diperpanjang di bawah 0,5–2,5 V versus Li + /Li-In.
Gambar 4
Buka di penampil gambar
Presentasi PowerPoint
Spektrum Raman in situ untuk mengungkap mekanisme siklus elektrokimia. a) Plot kontur 3D dan b) analisis spektrum yang sesuai (▼puncak dari Li 3 PS 4 , ☆puncak dari PSP, ▽puncak dari P═S, △puncak dari P─S, °puncak dari S─S,◇puncak dari Li 2 S, dan □puncak dari Li 2 S x ). c) Skema mekanisme reaksi kopling.
2.4 Evolusi Transportasi Muatan Antarmuka ASSLSB Berbasis KEGML
Berdasarkan plot Nyquist dari sel simetris Li-In/LPSC/Li-In dan dengan mempertimbangkan rangkaian ekivalen, nilai resistansi LPSC ( R SSE ) dan antarmuka LPSC/Li-In ( R 1SSE/LiIn ) ditentukan (Gambar S27a , Informasi Pendukung). [ 38 , 65 , 66 ] Selama siklus, ASSLSB dibongkar dan dipasang kembali dengan status tegangan yang sesuai (Gambar S27b , Informasi Pendukung). Pada status awal, resistansi total sel simetris Li-In/LPSC/katode/LPSC/Li-In ( R total ) dapat dijelaskan menurut Persamaan ( 1 ): [ 38 , 65 , 66 ]
![]()
di mana R t merupakan representasi resistansi transpor ionik efektif dalam komposit katode. [ 38 , 65 , 66 ] Akan tetapi, R SSE dan R 1SSE/LiIn berbeda dari keadaan setelah (dis)charging akibat reaksi sisi antarmuka dan redoks LPSC (antarmuka merah yang disorot pada Gambar S27b , Informasi Pendukung). [ 12 , 38 , 40 ] Oleh karena itu, R total sel simetris Li-In/LPSC/katode/LPSC/Li-In dapat dijelaskan secara wajar oleh Persamaan ( 2 ):
![]()
di mana R S dan R 2SSE/LiIn masing-masing mewakili resistansi LPSC dan resistansi antarmuka antara LPSC dan Li-In setelah siklus. Oleh karena itu, R t , R S , dan R 2SSE/LiIn adalah variabel yang perlu disesuaikan menurut spektrum impedansi (seperti yang ditunjukkan dalam kotak merah pada Gambar S27b , Informasi Pendukung). Nilai parameter impedansi menurut rangkaian ekuivalen (Gambar S27c , Informasi Pendukung sisipan) tercantum dalam Tabel S6 dan S7 (Informasi Pendukung). Nilai kesalahan yang terkait dengan penyesuaian impedansi, yang diekspor oleh perangkat lunak “Zview”, juga dimasukkan ke dalam Tabel S6 dan S7 (Informasi Pendukung). Plot Nyquist dan hasil penyesuaian yang sesuai dikumpulkan pada potensial yang berbeda selama siklus ke-20 dan ke-200 (Gambar S27c–h , Informasi Pendukung).
Selama siklus awal, tidak ada perubahan signifikan dalam R t katode S/KB@P bahkan setelah siklus ke-200 ( Gambar 5 a ). Secara komparatif, R t dan R s katode S/KB meningkat tajam selama proses pelepasan awal dan tidak kembali ke level awal hingga proses pengisian awal, tetapi menunjukkan peningkatan signifikan setelah 200 siklus. Peningkatan cepat katode S/KB dapat dikaitkan dengan dekomposisi reversibel LPSC. Dekomposisi reversibel ini tidak kondusif untuk stabilitas siklus jangka panjang, sebagaimana dibuktikan oleh peningkatan nilai impedansi setelah 200 siklus. [ 12 , 38 , 39 , 67 , 68 ] Impedansi katode S/KB@P secara umum ditemukan lebih rendah dan lebih stabil dibandingkan dengan katode S/KB. Jumlah transfer ionik sel simetris untuk katode S/KB@P lebih stabil dan lebih tinggi daripada katode S/KB (Gambar S28–S30 dan Tabel S8 , Informasi Pendukung). Hasil ini menunjukkan bahwa KEGML yang dimodulasi potensial awal berkontribusi pada stabilitas antarmuka dan mengurangi impedansi transpor ion. Selain itu, Li3PS4 – KEGML lebih efektif dalam mengatasi transportasi Li + yang tidak memadai yang disebabkan oleh kontak antarmuka padat-padat dan meningkatkan kinetika reaksi konversi daripada KEGML keadaan kimia lainnya.
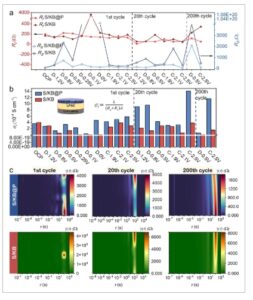
Gambar 5
Buka di penampil gambar
Presentasi PowerPoint
a) Nilai parameter impedansi menurut rangkaian ekivalen. b) Konduktivitas ion yang dihitung (lapisan katode & LPSC). c) Analisis DRT katode S/KB@P dan katode S/KB pada siklus ke-1, ke-20, dan ke-200.
Kemampuan transportasi ionik ( σ i ) selama siklus dievaluasi dan dihitung dengan Persamaan ( 3 ):
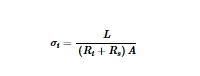
di mana L menyatakan ketebalan lapisan katode&LPSC (0,099 cm), dan A menyatakan luas elektroda (0,785 cm 2 ) (Tabel S9 , Informasi Pendukung). Sebelum pelepasan awal ke 0,5 V versus Li + /Li-In, tidak ada perbedaan signifikan dalam σ i antara katode S/KB@P dan S/KB (Gambar 5b ). Selama proses dari pelepasan awal pada 0,5–0 V versus Li + /Li-In, σ i katode S/KB@P mengalami penurunan diikuti oleh peningkatan, tetapi ada penurunan tajam pada katode S/KB. Ini menunjukkan bahwa KEGML menstabilkan konduktivitas katode selama modulasi potensial awal. σ i katode S/KB@P secara konsisten melebihi S/KB selama siklus berikutnya. Perbedaan σ i antara katode S/KB@P dan S/KB menjadi lebih jelas pada siklus ke-200. Li 3 PS 4 -KEGML yang terbentuk secara ireversibel pada 0 V versus Li + /Li-In, memfasilitasi transportasi Li + yang stabil selama siklus berikutnya dengan jendela potensial 0,5–2,5 V versus Li + /Li-In, sehingga menciptakan kondisi yang diperlukan untuk katode sulfur berkinerja tinggi. Dibandingkan dengan katode S/KB tanpa KEGML, ada peningkatan hampir delapan kali lipat dalam kemampuan transportasi ionik yang dicapai oleh katode S/KB dengan KEGML pada akhir siklus ke-200. Nilai konduktivitas ionik yang diperoleh dari metode polarisasi arus searah (DC) selanjutnya disediakan untuk dikuantifikasi dan dibandingkan (Gambar S31–S36 dan Tabel S10 , Informasi Pendukung). Tren variasi konduktivitas ionik selaras dengan yang diperoleh melalui pengukuran impedansi AC di atas. Telah diverifikasi lebih lanjut bahwa peningkatan hampir delapan kali lipat dalam kemampuan transportasi ionik oleh KEGML.
Untuk menyelidiki evolusi antarmuka katode selama siklus, teknik titrasi intermiten galvanostatik (GITT) dan spektroskopi impedansi elektrokimia (EIS) digunakan (Gambar S37, S38 , Informasi Pendukung). Resistensi transfer muatan yang tampak lebih kecil dan kinetika reaksi yang energetik di dalam katode setelah (dis)pengisian awal dapat dikaitkan dengan aktivasi KEGML dan S. [ 69 , 70 ] Beberapa proses elektrokimia tertentu menunjukkan konstanta waktu yang sangat cocok, yang dapat menyebabkan daerah setengah lingkaran dari spektrum EIS mereka menjadi berpasangan. Kopling ini membuatnya sulit untuk menyesuaikan sirkuit yang setara, terutama dalam sistem baterai semua-padat. [ 71 – 73 ] Dengan demikian, spektrum impedansi dianalisis lebih lanjut menggunakan metode DRT (Gambar 5c ), yang memungkinkan diferensiasi langsung dari proses elektrokimia dengan memanfaatkan sensitivitas berbagai reaksi elektrokimia dari waktu ke waktu. [ 71 , 74 ] Hal ini menyederhanakan analisis spektrum impedansi dan secara signifikan meningkatkan akurasi resolusi kinetiknya pada skala waktu yang berbeda. [ 74 , 75 ]
Kurva DRT terperinci yang sesuai dengan plot kontur ditunjukkan pada Gambar S39 (Informasi Pendukung). Puncak pada 10 −6 s sesuai dengan impedansi batas butir dalam SSE. [ 76 , 77 ] Impedansi ini relatif kecil dibandingkan dengan kontribusi impedansi ASSLSB secara keseluruhan pada waktu relaksasi lainnya. [ 71 ] Puncak antara 10 −1 –100 s dan 100–10 1 s sesuai dengan impedansi transpor antarmuka Li-In/LPSC dan katode/LPSC, masing-masing. [ 71 ] Puncak yang terletak pada 10 2 s sesuai dengan impedansi transfer muatan dalam katode. [ 70 , 78 ] Besarnya impedansi ini direpresentasikan oleh luas dan intensitas puncaknya yang sesuai. Selama siklus berlangsung, impedansi katode S/KB@P secara konsisten lebih rendah daripada katode S/KB, yang menunjukkan kinetika reaksi yang lebih unggul. Khususnya pada siklus ke-200, perbedaan yang nyata dalam impedansi transfer muatan menunjukkan bahwa kinetika reaksi yang cepat dan transportasi ion yang efektif dipertahankan dalam katode S/KB@P selama siklus yang panjang karena adanya Li3PS4 – KEGML .
2.5 Simulasi Komputasional Stabilitas Antarmuka Pembantu KEGML dan Transportasi Ion
Evolusi antarmuka kontak skala nano dalam katode S/KB@P selama (dis)charging dieksplorasi lebih lanjut menggunakan simulasi AIMD ( Gambar 6 a ). Setelah discharging selama 300 ps, tidak ada reaksi dekomposisi atau rekombinasi yang diamati di seluruh antarmuka S8 / KEGML/LPSC. Namun, antarmuka S8 / LPSC tanpa interfase Li3PS4 menunjukkan tampilan yang tidak teratur, yang disorot dengan lingkaran merah. Selama pengisian hingga 300 ps, komposisi material yang terletak di antarmuka antara Li2S / KEGML /LPSC tetap relatif stabil. Secara komparatif, perubahan struktural diamati pada antarmuka Li2S / LPSC, di mana LPSC yang rusak menyebabkan adanya PS3 piramida trigonal seperti yang ditunjukkan oleh lingkaran merah. Penipisan LPSC yang disebabkan oleh Li2S merusak jalur transpor ionik di sekitar material aktif, dan kerusakan ini terakumulasi selama siklus ASSLSB, yang memengaruhi reaksi elektrokimia jangka panjang. [ 12 , 13 ]
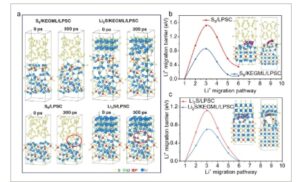
Gambar 6
Buka di penampil gambar
Presentasi PowerPoint
a) Perubahan struktural model S8/KEGML/LPSC, Li2S/KEGML/LPSC, S8/LPSC, dan Li2S/LPSC yang dipilih setelah simulasi AIMD ( 300 ps ) . b) Profil energi sepanjang jalur migrasi Li + pada antarmuka b) S8 / KEGML/LPSC, S8 / LPSC, c) Li2S / KEGML/LPSC, dan Li2S / LPSC.
Energi antarmuka rata-rata yang dihitung dapat digunakan untuk lebih jauh memperkirakan stabilitas antarmuka (Gambar S40 , Informasi Pendukung). Semakin tinggi kelebihan rata-rata energi antarmuka, semakin stabil antarmuka reaksi menjadi, mengurangi kemungkinan difusi antarmuka dan mencegah kehilangan material dan perubahan dalam keadaan kimia di antarmuka. [ 12 , 13 , 79 , 80 ] Penghalang energi migrasi Li + di antarmuka menyiratkan bahwa Li 3 PS 4 -KEGML menunjukkan penghalang energi yang berkurang untuk migrasi Li + , dengan demikian menunjukkan dampaknya yang menguntungkan pada transpor ion (Gambar 6b, c ). Jalur migrasi diilustrasikan oleh bola ungu. Secara keseluruhan, Li 3 PS 4 -KEGML tidak hanya berfungsi sebagai jalur ionik yang efisien tetapi juga meningkatkan stabilitas antarmuka kontak internal dalam katode selama siklus dan mencegah penipisan LPSC dan fenomena difusi antarmuka. Efek ini menunjukkan manfaat Li 3 PS 4 -KEGML dalam meningkatkan stabilitas antarmuka untuk meningkatkan kinerja elektrokimia selama siklus.
3 Kesimpulan
Di sini, KEGML yang sangat konduktif-ionik dan antarmuka-stabil dibangun in situ melalui modulasi potensial dalam ASSLSB. Fungsi utama KEGML untuk meningkatkan kinerja elektrokimia ASSLSB dapat disimpulkan sebagai berikut: 1) Mengaktifkan S dan meningkatkan pemanfaatan S; 2) Meningkatkan transportasi ion dalam faktor hampir delapan kali lipat dan mempercepat kinetika reaksi; 3) Mengurangi masalah reaksi samping antarmuka, kegagalan jalur ion yang diakibatkan oleh dekomposisi LPSC, dan kemungkinan penipisan S atau Li 2 S/LPSC selama siklus jangka panjang dan meningkatkan stabilitas antarmuka. Di antara semua keadaan kimia KEGML, ASSLSB berbasis Li 3 PS 4 -KEGML menunjukkan perilaku elektrokimia yang luar biasa, dengan stabilitas siklus yang luar biasa dari retensi kapasitas 99,9% selama ≈1,5 tahun dengan kapasitas spesifik 1578,9 mAh g −1 . Dengan menggunakan elektroda bermuatan S tinggi, katode mencapai kapasitas areal tinggi sebesar 13 mAh cm −2 . Lebih jauh, katode menunjukkan kemampuan adaptasi yang luar biasa terhadap variasi suhu. Karya ini menyajikan rute baru untuk secara bersamaan mencapai konversi S solid-state lengkap dan stabilitas siklus ultra-panjang dengan memodulasi potensi, memberikan wawasan berharga untuk rentang potensi terapan ASSLSB berkinerja tinggi.

