
Abstrak
Baterai logam seng cair (AZB) telah muncul sebagai alternatif yang menjanjikan untuk sistem penyimpanan energi berbasis litium karena biayanya yang rendah, keamanan intrinsik, dan sumber daya unsur yang melimpah. Namun, kelayakan komersialnya telah sangat dibatasi oleh tantangan kritis seperti pertumbuhan dendrit, korosi kimia, reaksi evolusi hidrogen, kemampuan beradaptasi suhu yang buruk, dan pelarutan katoda. Untuk mengatasi masalah ini, strategi elektrolit hibrida telah dieksplorasi secara ekstensif, karena dapat menstabilkan anoda logam Zn, katoda, dan antarmuka elektroda/elektrolit, yang menunjukkan potensi yang signifikan untuk AZB. Di sini, kemajuan terkini dalam desain elektrolit hibrida ditinjau secara komprehensif. Pertama, sifat dasar dan klasifikasi elektrolit hibrida dibahas. Kemudian, tantangan dan strategi pada anoda, katoda, dan elektrolit diperdebatkan secara sistematis. Lebih jauh, pertimbangan kritis, termasuk konduktivitas ionik, stabilitas elektrolit, jendela tegangan, dan reaksi samping, untuk desain elektrolit hibrida yang rasional ditangani, bersama dengan tantangan dalam mengoptimalkan kinerja baterai. Selain itu, tinjauan ini membahas masalah hambatan untuk AZB praktis, seperti produksi skala besar, pengendalian biaya, reproduktifitas, dan keamanan. Terakhir, prospek untuk elektrolit hibrida canggih diberikan, yang memandu pengembangan AZB praktis menuju teknologi penyimpanan energi masa depan.
1 Pendahuluan
Dengan pesatnya perkembangan pembangkitan tenaga surya dan angin, masalah fluktuasi intermiten menimbulkan tantangan bagi stabilitas jaringan. [ 1 ] Sistem penyimpanan energi elektrokimia telah menjadi salah satu solusi untuk mengurangi fluktuasi daya dan meningkatkan efisiensi energi. [ 2 ] Di antara penyimpanan energi elektrokimia, baterai lithium-ion adalah yang paling menjanjikan karena kepadatan energinya yang tinggi dan kinerja yang baik, tetapi sumber dayanya yang terbatas, biaya tinggi, dan masalah keamanan membatasi aplikasi skala besar. [ 3 ] Meskipun strategi baterai lithium-ion berair dapat mengatasi masalah keamanan yang terkait dengan elektrolit organik, [ 4 ] masih menghadapi tantangan seperti sumber daya yang terbatas, biaya tinggi, dan potensi deposisi Li yang tidak tepat. Dengan demikian, baterai logam seng berair (AZB) telah menerima perhatian luas sebagai teknologi di luar lithium-ion, karena keamanannya yang lebih tinggi, biaya yang lebih rendah, ramah lingkungan, dan potensi deposisi Zn yang tepat, untuk aplikasi menjadi solusi penyimpanan energi alternatif yang menjanjikan. [ 5 ]
Dari perspektif sifat elektrokimia dasar, logam Zn memiliki kapasitas teoritis yang tinggi, dengan kapasitas spesifik 820 mAh g −1 berat dan 5855 mAh cm −3 volume, [ 6 ] jauh melebihi litium (3860 mAh cm −3 ). [ 7 ] Selain itu, potensial redoks Zn adalah −0,76 V vs. elektroda hidrogen standar, yang menunjukkan stabilitas elektrokimia yang baik dalam lingkungan berair. [ 8 ] Yang lebih penting, sumber daya Zn melimpah di Bumi, diperkirakan sekitar ≈250 juta ton, jauh lebih tinggi daripada sumber daya litium (sekitar 89 juta ton). [ 9 ] Ini secara signifikan mengurangi ketidakpastian rantai pasokan dan biaya AZB. [ 10 ] Oleh karena itu, dalam penyimpanan energi skala besar, jaringan mikro, sumber daya listrik darurat, dan skenario aplikasi lainnya, AZB secara bertahap menunjukkan daya saing uniknya dan diharapkan menjadi bagian penting dari sistem energi bersih masa depan. [ 11 ]
AZB menghadapi keterbatasan karena sifat bawaan elektroda Zn dan elektrolit berair. [ 12 ] Telah dilaporkan bahwa lingkungan mikro pada antarmuka elektroda–elektrolit, seperti distribusi medan listrik, distribusi ion Zn, dan cacat permukaan logam Zn, dapat menyebabkan pertumbuhan dendrit Zn karena “efek ujung”, yang dapat menembus pemisah dan menyebabkan hubungan pendek internal. [ 12 , 13 ] Dibatasi oleh stabilitas elektrokimia air, elektrolit Zn berair, termasuk ZnSO 4 , Zn (OTf) 2 , dll., biasanya memiliki jendela elektrokimia sempit sekitar 1,23 V, yang menyebabkan reaksi evolusi oksigen pada potensial tinggi dan reaksi evolusi hidrogen (HER) pada potensial rendah, yang memengaruhi kinerja elektrokimianya. [ 8 , 14 ] Hal ini selanjutnya membatasi potensi AZB untuk mencapai kepadatan energi yang besar dan kisaran bahan elektroda yang berlaku. Selain itu, HER dapat menyebabkan akumulasi ion OH − pada antarmuka elektroda–elektrolit, yang mengakibatkan terbentuknya produk sampingan ireversibel (Zn 4 SO 4 (OH) 6 · X H 2 O), yang tidak hanya menurunkan efisiensi Coulombik tetapi juga menyebabkan kerusakan pada antarmuka elektroda Zn, yang mempercepat penurunan kinerja baterai. [ 11 , 15 ] Dalam lingkungan suhu rendah, laju transpor ion elektrolit berair menurun, dan kinetika reaksi elektroda melambat, yang mengakibatkan penurunan kapasitas dan siklus hidup yang lebih pendek, yang membatasi kemampuan beradaptasi mereka di lingkungan yang dingin atau ekstrem. Oleh karena itu, hal ini sangat penting untuk mengembangkan AZB yang stabil, tahan lama, berkinerja tinggi, dan andal.
Di antara berbagai pendekatan, rekayasa elektrolit dianggap sebagai strategi efektif untuk meningkatkan kinerja AZB karena persiapannya yang sederhana dan biaya rendah. [ 16 ] Biasanya, dengan menambahkan sejumlah kecil atau sedikit aditif ke garam Zn berair, struktur solvasi ion Zn atau interaksi antara aditif dan antarmuka dapat dimodulasi untuk meningkatkan kinerja elektrokimia. [ 17 ] Namun, elektrolit berair dengan kandungan air yang tinggi dapat menyebabkan perubahan fase ireversibel atau pembubaran bahan elektroda dan reaksi samping yang tidak diinginkan, yang pada gilirannya dapat menyebabkan evolusi hidrogen dan pertumbuhan dendrit.
Terhadap latar belakang ini, strategi elektrolit hibrida, yang dirancang untuk menggunakan dua atau lebih komponen elektrolit dalam kombinasi untuk mengatasi masalah yang disebutkan di atas yang menunjukkan keuntungan luar biasa, telah dikembangkan. [ 18 ] Tidak seperti aditif jejak dan strategi lainnya, elektrolit hibrida biasanya mengandung sejumlah besar pelarut organik, yang secara efektif dapat memodulasi jaringan ikatan hidrogen dalam elektrolit, sehingga meningkatkan transportasi ion Zn dan memastikan konduktivitas ion Zn yang tinggi pada suhu rendah. [ 7 , 19 ] Pada saat yang sama, ini dapat mengurangi aktivitas molekul air, sehingga menekan evolusi hidrogen dan reaksi samping lainnya, selanjutnya meningkatkan stabilitas elektrolit dan memperluas jendela tegangan efektifnya untuk mengakomodasi lebih banyak jenis bahan katode. [ 20 ] Selain itu, dengan merekonstruksi antarmuka elektroda-elektrolit dan memodulasi perilaku deposisi Zn, pembentukan dendrit dapat ditekan secara signifikan. Dengan mekanisme yang berbeda berdasarkan pelarutan dan redeposisi, baterai Zn-alkali, meskipun lebih matang secara komersial dalam aplikasi primer, menghadapi masalah kelarutan ZnO yang lebih parah ketika elektrolit hibrida diperkenalkan. Sebaliknya, elektrolit netral menawarkan keragaman dan kemampuan beradaptasi yang lebih besar, membuatnya lebih cocok untuk berbagai aplikasi, termasuk baterai fleksibel dan generasi berikutnya, di mana elektrolit hibrida dapat memberikan peningkatan kinerja lebih lanjut.
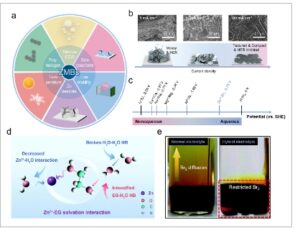
Sementara beberapa tinjauan telah mengeksplorasi berbagai strategi elektrolit untuk AZB netral, [ 7 , 21 ] tinjauan komprehensif tentang elektrolit hibrida, yang mencakup perspektif kimia elektrolit dan trade-off multivariabel dalam pengoptimalan kinerja, belum dilaporkan. Oleh karena itu, tinjauan ini bertujuan untuk mengisi kesenjangan, mengklarifikasi mekanisme elektrolit campuran dalam AZB, dengan fokus pada pengaruh komposisi elektrolit, regulasi antarmuka, dan konduktivitas ionik. Pertama, tinjauan ini merangkum aplikasi berbagai jenis elektrolit hibrida, dengan penekanan khusus pada keunggulannya dalam reaksi anoda dan katoda, kemampuan beradaptasi suhu, perluasan jendela tegangan, dan penekanan reaksi samping ( Gambar 1 ). Kami juga lebih jauh mengeksplorasi trade-off dalam desain elektrolit hibrida, termasuk menyeimbangkan konduktivitas ionik, stabilitas elektrolit, jendela tegangan, dan reaksi samping, dan menyoroti tantangan dalam mengoptimalkan kinerja baterai sambil menyeimbangkan faktor-faktor utama ini. Selain itu, tinjauan ini membahas masalah kemacetan dalam kinerja praktis AZB, seperti produksi skala besar, pengendalian biaya, reproduktifitas, dan keamanan. Terakhir, tinjauan ini melihat ke depan untuk masa depan elektrolit hibrida dalam AZB, menawarkan solusi potensial untuk meningkatkan kinerja baterai, memperpanjang masa pakai, mengurangi biaya, dan mencapai komersialisasi skala besar. Tinjauan ini juga memberikan dukungan teoritis dan panduan praktis yang signifikan untuk pengembangan AZB lebih lanjut, menawarkan perspektif dan arah baru bagi para peneliti di bidang ini.
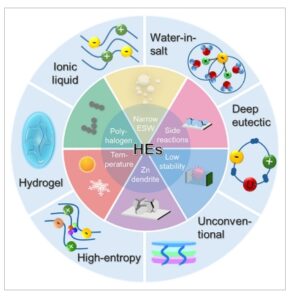
Gambar 1
Buka di penampil gambar
Kekuatan Gambar
Fungsi keseluruhan dan klasifikasi elektrolit hibrida untuk AZB.
2 Sifat Dasar dan Klasifikasi Elektrolit Hibrida
2.1 Sifat Dasar Elektrolit Hibrida
Elektrolit hibrida untuk AZB memiliki serangkaian sifat dasar yang secara intrinsik terkait dengan kinerja baterai, yang menentukan efisiensi, stabilitas, dan fungsionalitas keseluruhannya. Memahami sifat-sifat ini sangat penting untuk desain rasional dan pengoptimalan elektrolit hibrida guna memenuhi tuntutan sistem penyimpanan energi berkinerja tinggi.
2.1.1 Ikatan Hidrogen
Ikatan hidrogen (HB) memainkan peran penting dalam elektrolit hibrida, terutama untuk sistem berbasis air dengan molekul air yang melimpah. [ 27 ] Dalam air murni, jaringan HB yang luas terbentuk di antara molekul air. Ketika komponen lain diperkenalkan untuk membuat elektrolit hibrida, jaringan HB yang sudah ada sebelumnya ini terganggu dan dikonfigurasi ulang ( Gambar 2a ). [ 22 ] Penambahan pelarut organik, yang umumnya digunakan dalam elektrolit hibrida, seperti etilen glikol atau gliserol, ke elektrolit berair dapat menyebabkan pembentukan HB baru antara molekul pelarut dan air. Selain itu, kekuatan dan distribusi HB dapat memengaruhi viskositas dan sifat difusi elektrolit. HB dalam elektrolit hibrida adalah pedang bermata dua. Dalam elektrolit hibrida yang ditargetkan secara khusus, konfigurasi ulang HB adalah strategi desain yang disengaja. Interaksi HB yang lebih kuat dapat meningkatkan viskositas elektrolit, yang berpotensi memperlambat difusi ion. [ 28 ] Namun, jika jaringan HB dioptimalkan, ia juga dapat menyediakan jalur yang baik untuk transportasi ion, sehingga meningkatkan kinerja baterai secara keseluruhan (Gambar 2b ). [ 23 ] Dengan memahami dan mengendalikan interaksi molekuler ini, para peneliti dapat merancang elektrolit hibrida dengan sifat unggul yang menyeimbangkan viskositas dan mobilitas ionik, sehingga membuka jalan bagi solusi penyimpanan energi yang canggih.
Gambar 2
Buka di penampil gambar
Kekuatan Gambar
a) Berbagai jenis ikatan hidrogen. Direproduksi dengan izin. [ 22 ] Hak cipta 2024, Royal Society of Chemistry. b) Lingkungan larutan yang dimodifikasi oleh elektrolit hibrida. Direproduksi dengan izin. [ 23 ] Hak cipta 2023, National Academy of Sciences. c) Konduktivitas ionik, viskositas, dan nilai pH yang dimodifikasi oleh elektrolit hibrida. Direproduksi dengan izin. [ 24 ] Hak cipta 2023, Nature Portfolio. d) pH memengaruhi sistem baterai Zn. Direproduksi dengan izin. [ 25 ] Hak cipta 2021, Elsevier; Hak cipta 2020, American Association for the Advancement of Science. e) Interfase diatur oleh elektrolit hibrida. Direproduksi dengan izin. [ 26 ] Hak cipta 2024, Elsevier.
2.1.2 Konduktivitas Ionik
Konduktivitas ionik merupakan properti dasar untuk pengoperasian elektrolit baterai yang lancar. Dalam elektrolit hibrida, interaksi beberapa pelarut menghasilkan jaringan interaksi kompleks yang dapat meningkatkan atau menghambat properti penting ini. [ 29 ] Selama siklus pengisian-pengosongan, pergerakan ion yang tidak terhalang melalui elektrolit sangat penting untuk transfer muatan yang efisien antara anoda dan katoda. Memahami hubungan kompleks antara pelarut dalam elektrolit hibrida dan dampaknya pada konduktivitas ionik sangat penting untuk pengembangan elektrolit baterai berkinerja tinggi. Dengan menyetel komposisi dan interaksi dalam elektrolit secara hati-hati, peneliti dapat mengoptimalkan konduktivitas ionik untuk mencapai kinerja baterai yang lebih baik.
2.1.3 Viskositas
Viskositas adalah sifat penting yang memberikan pengaruh besar pada kinerja elektrolit hibrida. Dalam operasi baterai, ia memainkan peran penting dalam menentukan efisiensi transportasi ion. Elektrolit dengan viskositas rendah sangat diinginkan karena memungkinkan difusi ion yang cepat. [ 30 ] Ini sangat penting untuk proses siklus kecepatan tinggi, di mana pergerakan ion cepat diperlukan untuk mencapai keluaran daya tinggi. Selama pengisian daya kecepatan tinggi, ion perlu bergerak cepat dari katode ke anoda, dan elektrolit dengan viskositas rendah memfasilitasi proses ini. Sebaliknya, elektrolit dengan viskositas tinggi dapat bertindak sebagai penghalang difusi yang signifikan. Ketika viskositas tinggi, resistansi internal elektrolit meningkat, dan pergerakan ion sangat terhambat (Gambar 2c ). [ 24 ] Hal ini menyebabkan penurunan kinerja daya baterai, yang terwujud sebagai tegangan pelepasan yang lebih rendah dan efisiensi pengisian-pengosongan yang berkurang.
Selain itu, terdapat korelasi kuat antara viskositas dan overpotensial dalam elektrolit hibrida. Overpotensial ( η ) mengacu pada potensi tambahan yang diperlukan untuk mendorong reaksi elektrokimia pada laju tertentu, di atas potensi kesetimbangan. [ 31 ] Dalam konteks pengoperasian baterai, meminimalkan overpotensial sangat penting untuk meningkatkan efisiensi energi.
Ketika viskositas elektrolit meningkat, ion-ion menghadapi lebih banyak hambatan selama pergerakannya melalui elektrolit. Peningkatan hambatan ini menghasilkan energi aktivasi yang lebih tinggi yang diperlukan agar reaksi elektrokimia terjadi pada antarmuka elektroda-elektrolit. Akibatnya, diperlukan kelebihan potensial yang lebih tinggi untuk mendorong reaksi pada laju yang diinginkan. Di sisi lain, beberapa pelarut dapat meningkatkan viskositas dengan cara yang bermanfaat.
Memahami bagaimana berbagai pelarut memengaruhi viskositas elektrolit hibrida dan hubungannya dengan kelebihan potensial sangat penting untuk mengoptimalkan kinerja baterai. Dengan memilih dan menentukan proporsi pelarut secara cermat, para peneliti dapat mencapai keseimbangan yang tepat antara viskositas, difusi ion, kelebihan potensial, dan faktor-faktor terkait kinerja lainnya.
2.1.4 Tingkat keasaman (pH)
Nilai pH elektrolit hibrida berfungsi sebagai parameter penting, khususnya pada baterai Zn-ion berbasis air. Nilai pH memberikan pengaruh besar pada kinerja elektrokimia baterai, dan setiap penyimpangan dari pH optimal dapat memicu serangkaian efek yang merugikan. [ 32 ]
Dalam ZMB, pH yang tidak tepat dapat menyebabkan konsekuensi yang parah (Gambar 2d ). [ 25 ] Ketika pH terlalu rendah, dalam lingkungan asam, anoda Zn rentan terhadap korosi. Proton dalam elektrolit asam dapat bereaksi dengan anoda Zn, menghasilkan gas hidrogen melalui reaksi Zn + 2H + → Zn 2+ + H 2 . Hal ini tidak hanya menghabiskan bahan aktif anoda tetapi juga menyebabkan pembentukan gelembung hidrogen, yang dapat mengganggu antarmuka elektroda-elektrolit dan mengurangi efisiensi Coulombik baterai (CE). Di sisi lain, jika pH terlalu tinggi, dalam lingkungan basa, spesies Basa dapat terbentuk pada permukaan anoda, mengubah kimia permukaan dan menyebabkan pengendapan Zn yang tidak merata, yang berpotensi mengakibatkan pertumbuhan dendrit. Dendrit ini dapat menembus pemisah dan menyebabkan korsleting internal, yang secara signifikan memperpendek umur baterai. [ 11 ] Dalam elektrolit hibrida, komponen organik memainkan peran penting dalam pengaturan dan peningkatan pH.
2.1.5 Stabilitas Elektrokimia
Stabilitas elektrokimia merupakan persyaratan mendasar untuk pengoperasian elektrolit hibrida AZB yang andal. Elektrolit harus mempertahankan integritasnya selama siklus pengisian-pengosongan daya yang lama, memastikan tidak ada reaksi samping yang tidak diinginkan yang mengganggu kinerja baterai. Stabilitas dalam jendela elektrokimia—rentang tegangan antara potensial redoks anoda dan katoda—sangat penting untuk mencegah degradasi elektrolit, reaksi samping yang berlebihan, atau arus parasit yang dapat mengurangi efisiensi dan memperpendek masa pakai baterai.
Jendela elektrokimia ditentukan oleh batas oksidasi dan reduksi komponen elektrolit dalam kaitannya dengan bahan elektroda. Di anoda, elektrolit harus menahan dekomposisi saat terpapar pada kondisi reduksi tinggi, mencegah reaksi yang tidak diinginkan seperti kerusakan pelarut, pembentukan lapisan pasivasi, atau evolusi hidrogen (Gambar 2e ). [ 26 ] Di katoda, elektrolit harus tetap stabil terhadap oksidasi untuk menghindari jalur degradasi yang dapat menghasilkan produk sampingan isolasi, membahayakan transportasi ionik, atau menyebabkan evolusi gas, yang dapat menyebabkan penumpukan tekanan dan bahaya keselamatan. Untuk mencapai hal ini, pemilihan pelarut, garam, dan aditif dalam elektrolit hibrida dipandu oleh batas stabilitas elektrokimianya. Pelarut harus memiliki stabilitas oksidatif yang tinggi untuk mencegah degradasi di katoda sambil juga menunjukkan kompatibilitas dengan anoda logam Zn untuk meminimalkan reaksi samping yang dapat menyebabkan pembentukan dendrit atau kehilangan kapasitas. Spesies ionik yang ada dalam elektrolit juga harus menunjukkan kerentanan minimal terhadap aktivitas redoks dalam rentang tegangan operasi.
Dengan menyetel komposisi elektrolit secara cermat, para peneliti dapat memperpanjang jendela elektrokimia, meningkatkan stabilitas siklus, dan menekan mekanisme degradasi yang tidak diinginkan. Pengoptimalan ini merupakan kunci untuk meningkatkan kepadatan energi, efisiensi, dan umur baterai logam Zn secara keseluruhan, yang membuka jalan bagi penerapannya secara luas dalam teknologi penyimpanan energi.
2.2 Klasifikasi Elektrolit Hibrida
Garam Zn umum dalam AZB netral meliputi ZnSO4 , Zn(OTf) 2 , Zn(ClO4 ) 2 , ZnCl2 , Zn(BF4 ) 2 , Zn(TFSI) 2 , dll. Masing-masing menunjukkan keunggulan unik, seperti laju transfer ion tinggi, kompatibilitas suhu baik, dan sebagainya. [ 33 ] Dengan memperkenalkan berbagai jenis pelarut organik dengan fungsi spesifik ke dalam elektrolit berair ini, keragaman fungsional elektrolit hibrida dapat diperoleh. Tabel 1 merangkum pro dan kontra dari berbagai sifat elektrolit yang disebutkan, yang didasarkan pada konsensus dan tren dalam literatur yang ada, dan manifestasi spesifiknya bervariasi tergantung pada komposisi sistem dan rumus. Pada bagian berikut, berdasarkan berbagai fungsi dan jenis elektrolit hibrida, studi ini meninjau kemajuan terkini dalam sistem elektrolit ini dan prinsip-prinsip yang mendasarinya.
Tabel 1. Perbandingan sifat fisika dan elektrokimia serta fitur lain dari berbagai elektrolit hibrida.
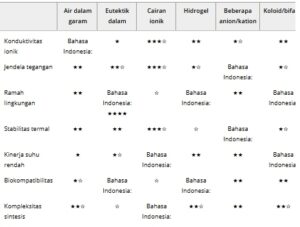
Pengurutan dari 1→4 ★ (Rendah/Sempit/Buruk→ Tinggi/Lebar/Sangat Baik; Peringkat bintang didasarkan pada konsensus dan tren dalam literatur yang ada, dan manifestasinya yang spesifik bervariasi bergantung pada komposisi sistem dan rumus).
2.2.1 Elektrolit Air dalam Garam
Air memiliki jendela stabilitas elektrokimia yang sempit (ESW, 1,23 V), sehingga menimbulkan tantangan yang signifikan bagi perangkat dengan kepadatan energi tinggi, seperti yang telah kami sebutkan. [ 19 ] Untuk mengatasi keterbatasan ini, konsep elektrolit air dalam garam (WiSE) telah diusulkan. Dalam sistem WiSE, garam dalam jumlah yang berlebihan ditambahkan melebihi batasan kelarutan, sehingga melampaui kandungan pelarut. [ 34 ] Pendekatan ini menurunkan aktivitas pelarut, meningkatkan stabilitas redoks elektrolit, memungkinkan operasi tegangan tinggi, dan mempertahankan transportasi ion yang cukup besar.
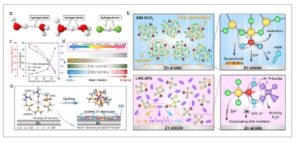
Tidak seperti elektrolit encer konvensional, WiSE menunjukkan struktur solvasi yang berbeda, seperti yang ditunjukkan pada Gambar 3a . [ 34 ] Ketika garam larut dalam air, kation dan anion bersaing untuk koordinasi. Dalam elektrolit encer, Zn 2+ biasanya dikoordinasikan oleh enam molekul air. Keadaan koordinasi utama dapat diklasifikasikan menjadi tiga rezim. Dalam larutan dengan konsentrasi di bawah 5 m, anion tetap terpisah dari kation dalam cangkang solvasi primer karena mediasi pelarut, membentuk pasangan ion yang dipisahkan pelarut (SSIP). Saat konsentrasi meningkat menjadi ≈5–10 m, proporsi pelarut bebas berkurang, dan kation dan anion mulai berkoordinasi dalam cangkang solvasi primer, membentuk pasangan ion kontak (CIP). Pada konsentrasi yang lebih tinggi, pelarut menjadi terikat sepenuhnya pada struktur solvasi kation, hampir tidak menyisakan pelarut bebas, yang mengarah pada pembentukan agregat ionik (AGG) seperti yang ditunjukkan pada Gambar 3b . Dalam sistem WiSE, keadaan CIP dan AGG dominan. Pelarut terikat secara termodinamika lebih stabil dibandingkan pelarut bebas, dan interaksi terkoordinasi antara kation dan anion menstabilkan elektron yang ditransfer, [ 35 ] sehingga meningkatkan stabilitas reduksi.
Gambar 3
Buka di penampil gambar
Kekuatan Gambar
a) Struktur solvasi air dalam garam dan garam dalam air. b) Ilustrasi struktur SSIP, CIP, dan AGG. Direproduksi dengan izin. [ 34 ] Hak cipta 2021, Wiley-VCH GmbH. c) penggambaran struktur solvasi unik dalam elektrolit eutektik. Direproduksi dengan izin. [ 36 ] Hak cipta 2019, Nature Portfolio. d) Contoh kation dan anion yang diaplikasikan dalam cairan ionik. Direproduksi dengan izin. [ 37 ] Hak cipta 2020, MDPI. e) PAM yang sangat terjerat sebagai alternatif pengikat silang dalam baterai ion seng. Direproduksi dengan izin. [ 38 ] Hak cipta 2024, Wiley-VCH GmbH. f) Diagram skema elektrolit entropi tinggi dengan kation terdiversifikasi. Direproduksi dengan izin. [ 39 ] Hak Cipta 2024, Wiley-VCH GmbH. g) Penggambaran peningkatan sifat elektrolit melalui sistem entropi tinggi atau diversifikasi kation, pelarut, dan anion. Direproduksi dengan izin. [ 40 ] Hak Cipta 2023, Nature Portfolio. h) Representasi skematis dari pembentukan lapisan antarmuka fase yang disebabkan oleh polarisasi konsentrasi. Direproduksi dengan izin. [ 41 ] Hak Cipta 2024, Nature Portfolio.
2.2.2 Elektrolit Eutektik Dalam
Dalam elektrolit berbasis air, korosi berkelanjutan terjadi karena air, dan reaksi kompetitif antara HER yang disebabkan oleh air dan pengendapan/pelepasan logam seng muncul. [ 42 ] Untuk mengurangi masalah ini, penelitian tentang elektrolit berbasis eutektik telah mendapatkan perhatian yang signifikan. Elektrolit eutektik menawarkan keuntungan yang memungkinkan operasi sel bahkan pada suhu rendah. Elektrolit ini menunjukkan reversibilitas yang sangat baik dan kompatibilitas yang kuat dengan antarmuka seng. Namun, tantangan utama terletak pada konduktivitas ioniknya yang relatif rendah, yang dihasilkan dari interaksi elektrostatik ion-molekul yang kuat atau ikatan hidrogen intermolekul. Akibatnya, keterbatasan ini membatasi kemampuannya untuk melepaskan energi sepenuhnya dalam bahan host berlapis. Pendekatan alternatif lain melibatkan penggunaan garam terhidrasi untuk mengembangkan elektrolit eutektik terhidrasi. Elektrolit eutektik berbasis garam terhidrasi ini menunjukkan pengurangan viskositas dibandingkan dengan elektrolit eutektik bebas air. Yang terpenting, karena struktur solvasinya yang unik (Gambar 3c ), elektrolit eutektik dapat menghambat korosi dan pasivasi seng yang disebabkan oleh molekul air aktif dan mencegah masalah pelarutan beberapa katoda. [ 36 ]
2.2.3 Elektrolit Cairan Ionik
Cairan ionik (IL) dapat digunakan sebagai elektrolit AZB karena kestabilan elektrokimianya, tidak mudah terbakar, tekanan uap rendah, dan sifat yang dapat disetel. [ 43 ] IL umumnya disebut sebagai “pelarut perancang” karena reaktivitas dan kemampuan solvasinya dapat disetel dengan baik. [ 44 ] Banyak IL yang tersusun dari kation berbasis imidazolium atau kation amonium kuarterner yang dikombinasikan dengan anion seperti Cl − , BF 4 − , OTf − , dan TFSI − (Gambar 3d ). [ 37 , 45 ] Selain itu, mereka telah menarik perhatian yang signifikan karena ketahanan apinya, stabilitas kimia yang sangat baik, dan stabilitas redoks yang melebihi 3 V. Namun, ikatan kation–anion yang kuat telah menyebabkan konduktivitas ionik yang rendah [ 46 ] dan dibandingkan dengan sistem elektrolit hibrida lainnya, potensi pelapisan/pelepasan seng yang sangat tinggi. [ 47 ]
Tantangan-tantangan ini secara signifikan menghambat kinerja pengisian/pengosongan daya dengan laju tinggi. Selain itu, biaya produksi relatif tinggi, [ 48 ] dan tantangan kritis dihadapi, khususnya dalam bahan baku dan proses pemurnian. Dalam proses pemurnian, metode pemurnian tradisional seperti distilasi dan ekstraksi tidak efektif, [ 49 ] menimbulkan kesulitan dalam mengadopsi pendekatan alternatif, sementara toksisitas juga tetap menjadi perhatian.
2.2.4 Elektrolit Hidrogel
Elektrolit hidrogel telah dianggap sebagai pengganti elektrolit cair, dan penelitian telah dilakukan di berbagai bidang, seperti baterai, superkapasitor, dan sel bahan bakar, karena dapat menggantikan separator karena sifat konduktif ionnya. [ 50 ] Elektrolit hidrogel disintesis dengan menanamkan elektrolit cair ke dalam matriks polimer yang berbeda (Gambar 3e ). [ 38 ] Karena fleksibilitas matriks polimer, ia mencegah kebocoran dan menunjukkan potensi untuk diterapkan pada perangkat yang dapat dikenakan atau elektronik fleksibel. Oleh karena itu, matriks polimer memerlukan sifat mekanis yang ditingkatkan untuk meningkatkan kinerja elektrolit hidrogel secara keseluruhan.
2.2.5 Anion/Kation Ganda/Elektrolit Entropi Tinggi
Elektrolit entropi tinggi juga baru-baru ini mendapatkan perhatian signifikan sebagai sistem elektrolit baru. Dengan mendiversifikasi komponen garam elektrolit atau pelarut, mengurangi energi bebas Gibbs melalui efek chaos, yang membantu mengurangi tatanan molekuler dan mengurangi ukuran gugus ion (Gambar 3f ). [ 39 ] Efek entropi tinggi ini menghasilkan viskositas rendah bahkan pada suhu rendah dan mencapai konduktivitas ion yang cukup besar. [ 51 ] Metode ini bekerja dengan mengurangi kompleks kation-anion dan pelarut, sehingga meningkatkan kinetika difusi ion dan meningkatkan stabilitas antarmuka (Gambar 3g ). [ 40 ]
2.2.6 Elektrolit Non-Konvensional (Koloid/Bifasik)
Dalam kasus koloid, partikel dengan rentang ukuran lebar dari puluhan nanometer hingga beberapa mikrometer terdispersi dalam fase elektrolit, yang memungkinkan penerapannya sebagai elektrolit (Gambar 3h ). [ 41 ] Karena kompatibilitasnya yang sangat baik dalam fase berair dan nonair, berbagai elektrolit koloid telah dilaporkan dalam bidang baterai logam litium dan baterai berair. Ada juga kasus di mana konduktivitas ion ditingkatkan dengan memasukkan partikel koloid yang dimodifikasi permukaan ke dalam pelarut dengan konstanta dielektrik rendah. [ 52 ] Alih-alih secara langsung memengaruhi struktur solvasi, partikel koloid ini teradsorpsi ke permukaan logam seng, membentuk lapisan pelindung yang meningkatkan stabilitas elektrokimia. [ 53 ] Elektrolit bifasik, yang menggunakan I 2 dengan tetrabutilamonium iodida dalam pelarut yang tidak bercampur dengan air diklorometana (CH 2 Cl 2 ), juga dikembangkan untuk menekan korosi silang I 2 dan elektroda Zn dan untuk mengurangi oksidasi sendiri elektrolit ZnI 2 . [ 54 ]
3 Tantangan Utama Elektrolit Hibrida untuk Baterai Logam Zn
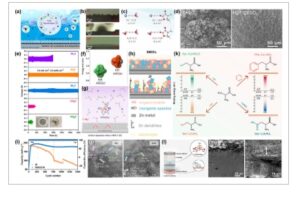
Untuk AZB berkinerja tinggi, anoda memainkan peran penting, tetapi anoda dihadapkan dengan beberapa tantangan berat yang sangat menghambat kinerja keseluruhan dan penerapan praktis baterai ( Gambar 4a ). Memahami masalah ini dan solusi yang ditawarkan oleh elektrolit hibrida sangat penting untuk pengembangan sistem penyimpanan energi berbasis Zn berkinerja tinggi.
Gambar 4
Buka di penampil gambar
Kekuatan Gambar
a) Masalah dasar dalam ZMB. b) Morfologi Zn terkait dengan kerapatan arus, dan c) Potensial redoks anoda logam tipikal. Direproduksi dengan izin. [ 56 ] Hak cipta 2024, Wiley-VCH GmbH. d) Pemotongan HB kuat air bebas oleh solvat. Direproduksi dengan izin. [ 59 ] Hak cipta 2020, Royal Society of Chemistry. e) Efek penghambatan elektrolit hibrida. Direproduksi dengan izin. [ 60 ] Hak cipta 2022, Royal Society of Chemistry.
3.1 Pertumbuhan Dendrit Zn
Pertumbuhan dendrit Zn adalah salah satu masalah yang paling membandel dan mengkhawatirkan dalam anoda logam Zn. Selama proses pengisian baterai, ion Zn direduksi dan diendapkan pada permukaan anoda. Namun, karena distribusi medan listrik yang tidak seragam dan dinamika transpor ion yang kompleks pada antarmuka elektroda-elektrolit, pengendapan ion Zn seringkali tidak seragam, yang mengarah pada pembentukan dendrit. [ 55 ] Dendrit adalah struktur seperti pohon yang dapat tumbuh selama beberapa siklus pengisian-pengosongan. Pertumbuhan dendrit Zn menimbulkan banyak ancaman terhadap kinerja dan keamanan baterai. Pertama, saat dendrit tumbuh, mereka dapat menembus pemisah untuk memisahkan anoda dan katoda secara fisik. Setelah dendrit menembus pemisah, terjadi hubungan pendek internal pada baterai. Hubungan pendek ini dapat menyebabkan pelepasan energi secara tiba-tiba, memicu panas berlebih, thermal runaway, dan dalam kasus ekstrem, kebakaran atau ledakan baterai. Kedua, pembentukan dendrit mengakibatkan konsumsi Zn yang tidak merata selama proses pengosongan. Seiring waktu, konsumsi yang tidak merata ini mengurangi bahan aktif anoda yang tersedia, sehingga memperpendek siklus masa pakai baterai. Selain itu, pembentukan daerah dengan konsentrasi Zn yang tinggi disebabkan oleh peningkatan pertumbuhan dendrit dalam kondisi arus yang melebihi batas.
Kepadatan arus memainkan peran penting dalam morfologi pengendapan Zn. Misalnya, pada kepadatan arus 1 mA cm −2 , Zn menunjukkan morfologi berlumut. Namun, dalam sampel yang dialirkan pada 100 mA cm −2 , langkah mikro yang jelas diamati, menghasilkan permukaan Zn yang halus, padat, dan berkilau. [ 56 ] Waktu pasir ( t sand ) mengacu pada waktu yang diperlukan untuk konsentrasi ion tertentu (seperti Zn 2+ ) pada permukaan elektroda untuk mencapai nol dalam kondisi arus yang melebihi batas (Gambar 4b ). Pada titik ini, pasokan ion ke permukaan elektroda menjadi tidak mencukupi, yang mengarah pada pembentukan lapisan penipisan muatan dan peningkatan tajam dalam potensial berlebih. Saat kepadatan arus meningkat lebih jauh, konsentrasi ion Zn dalam elektrolit berkurang dengan cepat, yang mendorong reduksi kation lain (seperti H + ). Hal ini tidak hanya menyebabkan peningkatan signifikan dalam kelebihan potensial tetapi juga memicu fenomena elektrokonvektif, yang pada gilirannya memperburuk pertumbuhan dendrit. Waktu Sand dapat dihitung mengikuti persamaan berikut:
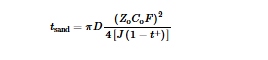
sedangkan d , c o , t + , Z 0 , F , dan J masing-masing berhubungan dengan koefisien difusi, konsentrasi, jumlah migrasi ion, muatan kation, konstanta Faraday, dan rapat arus. [ 57 ]
3.2 Jendela Elektrokimia Sempit
Jendela elektrokimia elektrolit dalam baterai didefinisikan sebagai rentang tegangan di mana elektrolit tetap stabil secara elektrokimia tanpa mengalami reaksi oksidasi atau reduksi yang signifikan. [ 58 ] Untuk AZB, jendela elektrokimia relatif sempit, biasanya dibatasi oleh reaksi redoks air (Gambar 4c ). Oksidasi air menjadi oksigen terjadi pada potensial positif yang relatif rendah (1,23 V vs SHE dalam larutan asam dan ≈0,82 V vs SHE dalam larutan netral), dan reduksi air menjadi hidrogen terjadi pada potensial negatif (−0,41 V vs SHE dalam larutan asam dan −0,83 V vs SHE dalam larutan netral).
Jendela elektrokimia yang sempit ini membatasi pilihan bahan katode dan tegangan keluaran baterai secara keseluruhan. Karena kerapatan energi baterai sebanding dengan perbedaan tegangan antara anoda dan katode, jendela elektrokimia yang sempit menghasilkan kerapatan energi yang lebih rendah. Misalnya, jika bahan katode tegangan tinggi memerlukan potensi operasi yang melebihi potensi oksidasi air dalam elektrolit, elektrolit akan terurai, dan baterai akan gagal beroperasi dengan baik. Elektrolit hibrida dapat dirancang secara strategis untuk memperluas ESW.
3.3 Reaksi Samping
Reaksi samping pada anoda Zn merupakan masalah utama dalam AZB. Keberadaan air dalam elektrolit berair membuat anoda rentan terhadap beberapa reaksi samping. Salah satu reaksi samping yang paling umum adalah reaksi antara Zn dan air, yang menyebabkan evolusi hidrogen. Persamaan kimia untuk reaksi ini adalah: Zn + 2H 2 O → Zn(OH) 2 + H 2 ↑. Reaksi ini tidak hanya menghabiskan material Zn aktif dari anoda tetapi juga menghasilkan gas H 2 , yang dapat terakumulasi di dalam baterai dan menyebabkan peningkatan tekanan internal. Jika tekanan melebihi toleransi kemasan baterai, hal itu dapat menyebabkan kebocoran atau bahkan pecahnya baterai.
Reaksi samping lainnya adalah korosi pada anoda Zn karena adanya pengotor dalam elektrolit atau reaksi dengan spesies asam atau basa dalam elektrolit. Di hadapan pengotor asam, anoda Zn dapat dilarutkan sesuai dengan reaksi: Zn + 2H + → Zn 2 ⁺ + H 2 ↑. Proses korosi ini mengurangi jumlah Zn aktif yang tersedia untuk reaksi pengisian-pengosongan dan juga dapat memasukkan ion logam ke dalam elektrolit, yang dapat memengaruhi kinerja katoda. Dengan peningkatan pH, reaksi parasit terjadi pada permukaan Zn:Zn 2+ + x OH − + y A − + n H 2 O → Zn(OH) x A y · n H 2 O. Oleh karena itu, elektrolit hibrida harus dirancang untuk memasivasi permukaan anoda dan mengurangi reaksi samping ini.
3.4 Stabilitas Rendah
Stabilitas anoda Zn selama beberapa siklus pengisian-pengosongan sangat penting untuk kinerja baterai jangka panjang. Dalam proses siklus, saat ion Zn dilapiskan dan dilepaskan dari permukaan anoda, anoda mengalami perubahan volume berulang. Perubahan morfologi ini menghasilkan tekanan mekanis di dalam anoda, yang dapat menyebabkan terlepasnya material aktif dari pengumpul arus dan terbentuknya retakan pada struktur anoda. Selain itu, paparan anoda yang terus-menerus terhadap elektrolit menyebabkan degradasi antarmuka padat-elektrolit (SEI), yang selanjutnya memengaruhi kinerja baterai. Elektrolit hibrida dapat meningkatkan stabilitas anoda melalui beberapa mekanisme, dengan pelarut organik dalam elektrolit hibrida memainkan peran penting.
3.5 Jendela Suhu Sempit
Jendela suhu operasi AZB sering kali terbatas, sementara suhu kerja menawarkan kinetika reaksi yang berbeda. [ 5 , 61 ] Pada suhu rendah, viskositas elektrolit meningkat, dan konduktivitas ionik menurun. Hal ini karena mobilitas ion dalam elektrolit berkurang pada suhu yang lebih rendah. Akibatnya, laju pengisian-pengosongan baterai melambat, dan kinerja daya baterai menurun. Misalnya, pada suhu yang sangat rendah, baterai mungkin tidak dapat memberikan daya yang cukup untuk menyalakan kendaraan listrik atau mengoperasikan perangkat elektronik portabel. [ 62 ]
Meskipun interaksi antar molekul HB yang kuat antara H 2 O dan pelarut organik dapat sangat melemahkan interaksi antara molekul H 2 O (Gambar 4d ), [ 63 ] dari perspektif persamaan Arrhenius, reaksi samping dapat dipercepat secara signifikan pada suhu tinggi: [ 64 ]
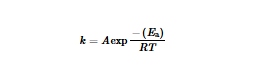
di sini, k adalah konstanta laju reaksi, A adalah faktor pra-eksponensial yang mewakili frekuensi reaksi awal, E a adalah energi aktivasi, R adalah konstanta gas (8,314 J mol −1 K −1 ), dan T adalah suhu. HER di anoda, serta pelarutan bahan katoda, dapat terjadi lebih cepat pada suhu yang lebih tinggi. Selain itu, stabilitas elektrolit dan elektroda dapat terganggu. Elektrolit dapat terurai atau mengalami reaksi kimia yang menyebabkan pembentukan produk sampingan, yang dapat memengaruhi kinerja baterai.
3.6 Pelarutan Katoda Berbasis Mn dan V
Katoda berbasis mangan dan vanadium sangat disukai dalam AZB karena kapasitas teoritis dan efektivitas biayanya yang relatif tinggi. Misalnya, mangan dioksida (MnO 2 ) memiliki kapasitas teoritis ≈308 mAh g −1 . Senyawa berbasis vanadium seperti vanadium pentoksida (V 2 O 5 ) dapat memungkinkan reaksi redoks multielektron berkapasitas tinggi. Namun, katoda ini menghadapi masalah pelarutan material yang parah dalam elektrolit.
Mengenai katode berbahan dasar mangan, lingkungan asam atau hampir asam dalam elektrolit, yang biasanya diakibatkan oleh keberadaan proton selama proses pengisian-pengosongan, dapat menyebabkan pelarutan ion mangan. Mekanisme reaksi utamanya terletak pada reduksi Mn(IV) dalam MnO2 menjadi Mn(II) dalam larutan elektrolit. Misalnya, selama proses pengosongan, reaksi berikut dapat terjadi: MnO2 + 4H⁺ + 2e⁻→ Mn2⁺ + 2H2O . Saat baterai berputar, pelarutan Mn2 + yang terus-menerus ke dalam elektrolit secara bertahap mengurangi jumlah MnO2 aktif di katode, yang menyebabkan penurunan kapasitas baterai secara signifikan. Pada elektrolit berair tradisional, bahkan dengan penambahan sejumlah kecil Mn 2+ untuk mencegah pembubaran elektroda MnO 2 , kapasitas baterai Zn||MnO 2 menurun lebih dari 40% setelah 80 siklus. [ 65 ]
Katoda berbasis vanadium juga mengalami masalah pelarutan yang serupa. [ 66 ] Ion vanadium dapat larut ke dalam elektrolit, terutama pada kondisi pH dan potensial redoks tertentu. Pelarutan spesies vanadium tidak hanya mengurangi bahan aktif katoda tetapi juga dapat menyebabkan masalah seperti kontaminasi elektrolit dan pembentukan endapan dari waktu ke waktu, yang dapat menyumbat saluran transpor ion dalam baterai. Pelarutan ion vanadium dipercepat pada laju pengisian daya yang tinggi, yang menyebabkan penurunan kinerja baterai dengan cepat. [ 67 ] Elektrolit hibrida menyediakan berbagai strategi untuk mengurangi pelarutan katoda berbasis mangan dan berbasis vanadium, dengan pelarut organik memainkan peran penting.
3.7 Efek Shuttle dan Korosi Spesies Polihalogeno
Efek shuttle merupakan kendala utama dalam sistem katode halogen, terutama yang melibatkan spesies polihalida (Gambar 4e ). [ 60 ] Pada baterai dengan katode yang mengandung polihalida, seperti baterai Zn-iodin di mana spesies poliiodida (I 3 − , I 5 − , dll.) berpartisipasi dalam reaksi pengisian-pengosongan, spesies polihalida dapat bermigrasi antara katode dan anoda melalui elektrolit. Fenomena ini dikenal sebagai efek shuttle.
Efek shuttle menyebabkan serangkaian konsekuensi yang merugikan. Pertama, efek ini menyebabkan baterai mengeluarkan daya sendiri. Karena spesies polihalida berpindah-pindah di antara elektroda, mereka dapat berpartisipasi dalam reaksi redoks pada elektroda yang salah, menghabiskan energi yang tersimpan dalam baterai bahkan saat tidak digunakan. Kedua, migrasi spesies polihalida yang berkelanjutan dapat menyebabkan korosi pada bahan anoda dan katoda. Misalnya, dalam baterai Zn-iodin, ion poliiodida dapat bereaksi dengan anoda Zn, mempercepat korosi pada anoda dan memperpendek masa pakainya. Selain efek shuttle, spesies polihalida juga rentan terhadap korosi di lingkungan elektrolit. Oksidasi atau reduksi spesies polihalida dapat dipengaruhi oleh pengotor dalam elektrolit atau keberadaan spesies reaktif lainnya. Misalnya, ketika sejumlah kecil oksigen atau ion logam tertentu hadir dalam elektrolit, spesies polihalida dapat teroksidasi atau tereduksi dengan cara yang tidak diinginkan, yang mengakibatkan penurunan kinerja katoda.
Singkatnya, katode AZB menghadapi serangkaian masalah kompleks, termasuk pelarutan katode berbasis mangan dan vanadium, efek shuttle dan korosi spesies polihalida, self-discharge, dan kebutuhan untuk mencocokkan jendela tegangan untuk reaksi multielektron. Elektrolit hibrida menyediakan serangkaian solusi inovatif untuk masalah ini, yang penting untuk pengembangan AZB berkinerja tinggi dan andal. Penelitian lebih lanjut di bidang ini diharapkan dapat menghasilkan kemajuan signifikan dalam teknologi baterai, yang memungkinkan penerapan baterai berbasis Zn yang lebih luas di berbagai bidang, seperti elektronik portabel, kendaraan listrik, dan penyimpanan energi skala jaringan.
Afinitas elektrolit hibrida terhadap gugus polihalogen dikaitkan dengan sifat dan mekanisme reaksi unik dalam baterai. Meskipun fenomena perpindahan polihalogen secara serius membatasi kinerja elektrokimia baterai Zn-halogen, pelarut organik dalam elektrolit hibrida memainkan peran penting dalam menekan fenomena ini. [ 68 ] Elektrolit hibrida, termasuk pelarut organik, dapat menekan perpindahan poliiodida melalui beberapa mekanisme, yang sangat penting untuk menekan perpindahan poliiodida. Dengan memilih dan merumuskan pelarut organik yang berbeda secara rasional, kinerja baterai Zn-iodin dan sistem baterai terkait lainnya dapat ditingkatkan secara efektif, yang meletakkan dasar untuk aplikasi dan pengembangan teknologi baterai di lebih banyak bidang.
4 Strategi dan Fungsi Representatif
Elektrolit hibrida telah muncul sebagai solusi transformatif untuk tantangan kritis dalam AZB netral, terutama termasuk pembentukan dendrit Zn, reaksi samping, ketidakstabilan elektrolit, dan kinetika reaksi lambat pada sisi katode. [ 59 , 69 ] Tidak seperti elektrolit berair konvensional, sistem ini mengintegrasikan molekul kecil, garam anorganik, pelarut organik, nanomaterial, dan polimer untuk mencapai sifat elektrokimia yang disesuaikan. Berdasarkan fungsi yang berbeda, secara sistematis dapat dikategorikan ke dalam empat bagian utama: stabilisasi anoda, kompatibilitas katode, formulasi elektrolit, dan desain baterai secara keseluruhan. Setiap bagian membahas tantangan khusus dalam baterai berbasis Zn dan mengeksplorasi bagaimana kemajuan dalam rekayasa elektrolit hibrida meningkatkan daya tahan, efisiensi, dan kinerja baterai secara keseluruhan sambil menginspirasi inovasi untuk desain generasi berikutnya. Perhatikan bahwa fungsi-fungsi ini dapat tumpang tindih dalam skenario tertentu, karena elektrolit hibrida secara inheren multifungsi dalam sistem baterai elektrokimia yang digabungkan dengan banyak medan tersebut. Namun, fokus utama tetap pada efek utama dan hasil terkaitnya.
4.1 Stabilisasi Anoda
4.1.1 Regulasi Pelarutan Ion Zn
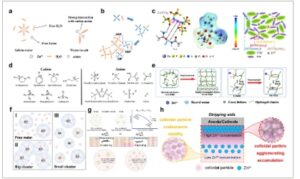
Ide inti dari regulasi solvasi adalah untuk mengeluarkan molekul air aktif dari struktur solvasi Zn 2+ dan menggantinya dengan molekul dan ion melalui interaksi (koordinasi) yang lebih kuat yang memiliki struktur/fungsi yang diinginkan dalam lingkungan yang sangat terhidrasi. Struktur solvasi terutama dipengaruhi oleh ikatan hidrogen, momen dipol ionik, dan gaya antarmolekul. Oleh karena itu, sistem elektrolit garam ganda yang menggabungkan seng sulfat (ZnSO 4 ) dan Zn(OTf) 2 dapat dengan mudah menurunkan penghalang energi untuk desolvasi Zn 2+ dan deposisi Zn ( Gambar 5a ). [ 70 ] Pelapisan dan pelepasan Zn terjadi lebih seragam, secara efektif meminimalkan pertumbuhan dendrit yang terjadi di ZnSO 4 bersamaan dengan evolusi gas dalam sistem garam tunggal Zn(OTf) 2 (Gambar 5b ). Elektrolit menunjukkan konduktivitas ionik tinggi sebesar 5,1 × 10 −10 m 2 s −1 , dan mencapai CE sebesar 98,2% dalam sel Zn||Cu selama 520 jam. Selain itu, dengan membentuk ikatan hidrogen dengan air, urea memodifikasi kulit solvasi secara tidak langsung dengan aktivitas air yang rendah dan meminimalkan HER. [ 29 ] Pelarut organik dengan kerapatan elektron dan aktivitas elektrokimia yang lebih tinggi daripada H 2 O juga efektif dalam mengatur struktur pelarut ion Zn. [ 71 ] Elektrolit hibrida berbasis organik juga efektif dalam mengatur struktur pelarut ion Zn (Gambar 5c,d ). [ 71 ] Elektrolit eutektik dalam yang diaktifkan oleh kelembapan (ZADEE-4H 2 O), terdiri dari ZnCl 2 , kolin klorida, Etilen glikol (EG), dan H 2 O, di mana kadar air memegang kunci untuk struktur solvasi [ZnCl(EG) 2 (H 2 O) 2 ] + . [ 72 ] Perbedaan yang jelas dalam siklus baterai dan anoda Zn pasca siklus diamati dengan memvariasikan kandungan air (Gambar 5e ), memberikan demonstrasi yang baik untuk penyetelan halus komposisi elektrolit.
Gambar 5
Buka di penampil gambar
Kekuatan Gambar
a) Ilustrasi skema deposisi Zn dalam elektrolit hibrida ZnSO4 / Zn(OTf) 2 , dan b) gambar mikroskopi in situ proses pelapisan Zn pada 10 mA cm −2 dalam elektrolit hibrida ZnSO4 , Zn(OTf) 2 , dan ZnSO4 /Zn( OTf ) 2 . Direproduksi dengan izin. [ 70 ] Hak cipta 2023, Elsevier. c) Energi pengikatan antara 3-hidroksi-4,5-dimetil-2(5H)-furanon (HDF) dan Zn2 + , H2O , dan Zn2 + , dan d) Gambar SEM Zn yang diendapkan dalam elektrolit HDF/ZnSO4 pada 5 mA cm −2 . Direproduksi dengan izin. [ 71 ] Hak cipta 2023, American Chemical Society. e) Perbandingan kinerja siklus galvanostatik jangka panjang sel simetris Zn||Zn dalam berbagai elektrolit ZADEE -n H 2 O terhidrasi pada 0,5 mA cm −2 dengan kapasitas areal 0,5 mAh cm −2 . Sisipan menunjukkan foto digital anoda Zn setelah 1000 siklus elektrolit ZADEE-4H 2 O dan −16H 2 O. Direproduksi dengan izin. [ 72 ] Hak cipta 2023, Elsevier. f) Tingkat energi LUMO dari Zn(H 2 O) 6 2+ dan ZnI(H 2 O) 5 + , dan g) Skema I − yang menyuntikkan elektron untuk menstabilkan struktur solvasi, sementara lapisan pelindung elektrostatik NH 4 + menghambat pertumbuhan dendritik Zn. Direproduksi dengan izin. [ 74 ] Hak Cipta 2022, American Chemical Society. h) Dendrit dan reaksi samping pada anoda Zn dalam ZF dan SEI anoda Zn dalam elektrolit eutektik terner yang berasal dari garam logam ganda, dan i) kinerja siklus sel penuh Zn||PANI pada 1 A g −1 . Direproduksi dengan izin. [ 77 ] Hak Cipta 2025, Wiley-VCH GmbH. j) Gambar TEM antarmuka pada permukaan Zn yang diendapkan dalam 0SL dan 70SL. Direproduksi dengan izin. [ 24 ] Hak Cipta 2023, Nature Portfolio. k) Skema untuk berbagai turunan asam amino dan situasi koordinasi dengan Zn 2+ . Direproduksi dengan izin. [ 78 ]Hak cipta 2024, Springer Nature Link. l) Skema struktur solvasi Zn dan antarmuka hidrofobik yang dihasilkan untuk desain baterai bebas anoda, dan (m) pengupasan ke-100 dalam 50%PC-sat. (kiri), dan tanpa elektrolit PC (kanan). Direproduksi dengan izin. [ 79 ] Hak cipta 2022, American Chemical Society.
Kelompok anion tertentu, yaitu halida, telah diberi perhatian lebih dalam sistem elektrolit hibrida. [ 73 ] Dengan menggabungkan iodida (I − ), elektrolit hibrida menggantikan air sebagian dalam kulit solvasi Zn 2+ , membentuk struktur ZnI(H 2 O) 5 + yang stabil , mengurangi transfer elektron air ke Zn 2+ dengan peningkatan tingkat energi orbital molekul paling tidak terisi (LUMO) (Gambar 5f ), dan menekan HER. [ 74 ] Selain itu, kation amonium (NH 4 + ) yang ditambahkan menciptakan lapisan pelindung elektrostatik pada permukaan Zn, mencegah pembentukan dendrit (Gambar 5g ). [ 74 ] Konduktivitas ionik ditingkatkan menjadi 203,2 mS cm −1 , dan resistansi transfer muatan dikurangi menjadi 77 Ω dibandingkan dengan elektrolit seng asetat asli. Penggantian atau penggabungan I− dengan halida lain juga sangat efektif, sementara gugus fungsi NH4 + dapat dimodifikasi dan dioptimalkan agar sesuai dengan komposisi garam tertentu. [ 75 ] Bahkan sejumlah kecil I− ( 50 m m ) terbukti berfungsi sebagai lapisan kaya anion untuk menurunkan penghalang energi desolvasi Zn2 + dari 74,33 menjadi 32,26 kJ mol −1 dalam campuran 50:50 1,2-dimetoksietana (DME) dan air, [ 76 ] dan DME mengatur cangkang solvasi, memungkinkan siklus sel simetris yang stabil pada DOD tinggi 75,5% selama 300 jam pada kerapatan arus 8,85 mA cm −2 .
4.1.2 Pembentukan Interfase Elektrolit Padat
Selain peran dalam memodulasi struktur solvasi Zn, elektrolit hibrida dapat berpartisipasi dalam pembentukan SEI melalui degradasi pengorbanan dalam proses yang menghambat reaksi samping yang tidak diinginkan antara Zn dan air. Berbeda dari baterai litium, keamanan sistem berair yang secara inheren lebih tinggi memungkinkan rentang komposisi elektrolit yang lebih luas. Oleh karena itu, berbagai strategi dikembangkan untuk SEI fungsional yang berbeda.
A) SEI anorganik–organik
Pelarut organik mengandung gugus fungsi dengan elektrolit hidrofobik dan zincophilic yang akan didekomposisi menjadi SEI unik ini. SEI anorganik–organik yang terdiri dari polimer polietilena oksida, garam alkil karbonat ((ROCO 2 ) 2 Zn), alkil karbonat (R–O–CO–O–R), dan ZnCO 3 yang dihasilkan dari dekomposisi EC, mendorong peningkatan siklus baterai dengan HER yang ditekan. [ 80 ] Organik yang lebih kompleks seperti etanesulfonamida (ESA) dengan gugus fungsi zincophilic-SO 2 NH 2 dan alkil hidrofobik terbukti membantu dalam menargetkan reaksi samping terkait air melalui SEI yang terdiri dari fase dalam yang kaya anorganik terutama seng sulfida (ZnS) dan fase luar yang kaya organik. [ 81 ]
B) SEI yang menyembuhkan diri sendiri
Contoh yang melibatkan ZnS sebagai komponen SEI yang menggabungkan dimetil sulfoksida (DMSO) dengan nomor donor Gutmann tinggi ke dalam sistem ZnCl 2 –H 2 O, lapisan SEI penyembuhan sendiri, kaya akan Zn 12 (SO 4 ) 3 Cl 3 (OH) 15 ·5H 2 O, ZnSO 3 , dan ZnS, secara selektif memungkinkan transportasi Zn 2+ dan memblokir H 2 O, memungkinkan ≈100% CE baterai selama 400 jam. [ 82 ]
C) Strategi kosolven
Strategi kosolven juga dapat memainkan peran efektif dalam mengatur komponen SEI secara tepat. Elektrolit hibrida berbasis Zn(OTf) 2 /1,3-dimetil-perhidro-2-pirimidinon (DMPU) dapat memfasilitasi pembentukan SEI hibrida yang mengandung komponen organik/anorganik (ZnF 2 , ZnS, ZnCO 3 , ─CF 3 , ─SO 3 ), yang mencegah kontak air langsung dengan permukaan Zn. [ 83 ] Setengah-sel SEI@Zn||Cu dengan elektrolit yang dioptimalkan (DMPU, 60 v%) memiliki kelebihan potensial yang menurun dari 141 menjadi 107 mV, yang menunjukkan kinetika transpor Zn yang ditingkatkan dan perilaku pelapisan/pelepasan yang stabil.
D) Air dalam garam
Campuran elektrolit yang menggabungkan litium bis(trifluoromethanesulfonyl)imide (LiTFSI)/tetraethylene glycol dimethyl ether (TEGDME) ke dalam elektrolit berair ZnSO4 2 m secara efektif mengatur solvasi Zn2 + . [ 84 ] Mekanisme penyetelan cangkang solvasi ganda dengan TEGDME membentuk struktur solvasi primer dengan aktivitas air yang berkurang. Sebaliknya, ion – ion TFSI− menyusun cangkang solvasi luar untuk melemahkan interaksi elektrostatik Zn dan O. SEI kerangka Zn4 ( OH) 6SO4⋅5H2O dan pengisian ZnF2 membantu mengurangi dendrit Zn dan overpotensial melalui keberadaan Li + .
e) Sistem multieutektik
Sistem multieutektik (Gambar 5h ) yang melibatkan LiTFSI, [ 77 ] dan seng triflat dengan litium perklorat (LiClO4 ) [ 85 ] dapat membentuk cangkang solvasi unik dan SEI kaya anorganik yang mengandung ZnF2 , ZnS, ZnSO3 , ZnCO3 , dan ZnO, sehingga mengurangi aktivitas air dan menekan HER yang menunjukkan peningkatan kinerja (Gambar 5i ). Selain itu, komposisi SEI dapat diatur secara tepat dengan memperkenalkan pelarut eutektik yang berbeda. SEI bebas ZnF2 yang terdiri dari ZnCO3 – ZnO/Zn(OH) 3– ZnS–sulfit dapat diperoleh dengan menggunakan sulfolana dan air dengan rasio berat 7:3 (Gambar 5j ). [ 24 ] Hibrida organik–anorganik SEI terdiri dari ZnO, ZnS, dan ZnS 3 yang dibentuk dengan menggunakan asam amino amfipatik—fenilalanin (Gambar 5k ). [ 78 ]
Tidak seperti regulasi solvasi Zn 2+ saja, penyelidikan yang lebih komprehensif terhadap mekanisme pembentukan SEI, komposisi, dan stabilitas jangka panjang—baik selama siklus awal maupun operasi jangka panjang—sangat penting. Mengatasi tantangan ini memerlukan pendekatan metodologis yang tepat dan canggih. Studi sistematis pada berbagai konsentrasi elektrolit sangat penting untuk menetapkan standar dasar, yang pada akhirnya memandu pengembangan aplikasi yang hemat biaya dan dapat diskalakan.
4.1.3 Desain Ulang dan Stabilisasi Anoda
Strategi penting lainnya untuk stabilisasi anoda adalah mendesain ulang anoda, termasuk konstruksi saluran hidrofobik pada permukaan Zn dan desain bebas anoda. Dengan menambahkan gugus sulfonat zinkofilik sulfobutylether-beta-siklodekstrin, saluran hidrofobik pada permukaan Zn akan terbentuk, yang mengurangi aktivitas air, mendorong difusi Zn 2+ yang seragam , dan pengendapan dengan menurunkan kelebihan potensial nukleasi. [ 86 ] Penambahan ZnF 2 ke dalam elektrolit ZnSO 4 menciptakan lapisan antarmuka kaya fluor yang menekan evolusi gas di samping mengatur pengendapan Zn, memungkinkan baterai bebas anoda dengan efisiensi siklus Zn yang tinggi sebesar 99,87%. [ 87 ] Desain permukaan Zn dengan fungsi kedap air dengan memanfaatkan efek penggaraman Zn(OTf) 2 , elektrolit hibrida air–propilena karbonat (PC) dikembangkan yang mempertahankan kelarutan antara air dan PC (Gambar 5l ), menunjukkan peningkatan kinerja baterai (Gambar 5m ). [ 79 ] Pemahaman yang lebih dalam tentang elektrolit hibrida akan memfasilitasi evolusi arsitektur baterai Zn yang lebih komprehensif dan sistematis, khususnya dalam desain anoda.
Yang terpenting, elektrolit hibrida telah merevolusi stabilitas anoda Zn dengan mengatur solvasi ion Zn, menekan reaksi parasit, dan memungkinkan pembentukan SEI yang kuat. Dengan memanfaatkan elektrolit konsentrasi tinggi, aditif fungsional, dan strategi kosolven, mereka secara efektif mengurangi pertumbuhan dendrit, HER, dan hambatan utama korosi untuk kinerja jangka panjang. Kemajuan ini meningkatkan baterai berbasis Zn dan memungkinkan desain bebas anoda dengan kepadatan energi dan keamanan yang lebih tinggi. Namun, diperlukan pengoptimalan lebih lanjut, misalnya, mengintegrasikan kecerdasan buatan dan pembelajaran mesin dapat mempercepat desain elektrolit dan memprediksi evolusi SEI, sementara pemahaman yang lebih dalam tentang sifat fisik elektrolit—viskositas, mobilitas ionik, dan volatilitas—sangat penting untuk aplikasi praktis. Menyeimbangkan konduktivitas ionik, stabilitas antarmuka, dan efektivitas biaya sangat penting untuk skalabilitas. Upaya di masa mendatang harus menyempurnakan penyetelan solvasi, rekayasa SEI, dan interaksi elektrolit–elektroda untuk meningkatkan reversibilitas dan memungkinkan implementasi di dunia nyata.
4.2 Kompatibilitas Katoda
Untuk sisi katode, elektrolit hibrida umumnya diformulasikan secara strategis untuk meningkatkan kinerja elektrokimia, stabilitas material, keandalan, dan daya tahan. Mengingat beragamnya perilaku elektrokimia dan keterbatasan inheren berbagai material katode—seperti berbasis mangan, berbasis vanadium, sulfur, senyawa halogen, dan lainnya—modifikasi elektrolit yang disesuaikan telah dieksplorasi. Pendekatan ini berfokus pada peningkatan kinetika redoks, penyempurnaan antarmuka katode-elektrolit, penyesuaian komposisi elektrolit yang menguntungkan, meminimalkan reaksi redoks yang tidak diinginkan, dan perluasan ESW untuk meningkatkan stabilitas siklus dan masa pakai baterai secara keseluruhan. Karakteristik yang ditunjukkan oleh berbagai material katode sangat bervariasi, sehingga pengoptimalan material katode memerlukan formulasi elektrolit hibrida yang ditargetkan dan terspesialisasi. Kebutuhan berbagai material tidak dapat digeneralisasi, dan memastikan stabilitas baterai dan masa pakai yang lama memerlukan pendekatan khusus. Selanjutnya, kita akan membahas strategi dan fungsi elektrolit hibrida berdasarkan berbagai jenis material katode.
4.2.1 Katoda Berbasis Vanadium
Katoda berbasis vanadium (oksida), seperti V 2 O 5 , menghadapi tantangan seperti konduktivitas terbatas dan pelarutan vanadium. [ 88 ] Oleh karena itu, menstabilkan pH antarmuka positif, menghambat aktivitas air dan penyisipan bersama H dianggap sebagai strategi efektif untuk meningkatkan kinerja elektroda berbasis V. Trietil fosfat [ 89 ] dan tripropil fosfat (TPP) [ 90 ] dilaporkan sebagai pelarut yang berguna untuk mengatur ulang jaringan ikatan hidrogen, membentuk lapisan antarmuka katoda-elektrolit (CEI) yang kuat yang diperkaya dengan Zn 3 (PO 4 ) 2 , ZnS, dan ZnF 2 , yang mengurangi pelarutan vanadium ( Gambar 6a ) yang menunjukkan kapasitas reversibel tinggi sebesar 256,9 mAh g −1 selama lebih dari 1000 siklus dalam sel Zn–V 2 O 5 (Gambar 6b ).

Gambar 6
Buka di penampil gambar
Kekuatan Gambar
a) Skema mekanisme fungsi pada katode V 2 O 5 dan anoda Zn dalam elektrolit TPP40 dibandingkan dengan elektrolit bebas TPP, dan (b) kinerja siklus sel penuh Zn||V 2 O 5 pada laju arus 3 C. Sisipan adalah gambar optik separator yang didaur ulang dalam elektrolit TPP0 dan TPP40. Direproduksi dengan izin. [ 90 ] Hak cipta 2025, Wiley-VCH GmbH. c) XRD in situ transformasi fase katode dalam elektrolit yang berbeda. Direproduksi dengan izin. [ 93 ] Hak cipta 2022, Wiley-VCH GmbH. d) Hubungan CE, pH, kapasitas, dan elektrolit hibrida Zn 2+ /Mn 2+ . Direproduksi dengan izin. [ 94 ] Hak cipta 2020, Wiley-VCH GmbH. e) Energi pengikatan S 2− ke Zn 2+ , EG, dan H 2 O dalam pelarut EG-50 dengan konfigurasi yang dioptimalkan. Direproduksi dengan izin. [ 95 ] Hak cipta 2022, Wiley-VCH GmbH. f) Baterai Zn/S yang dirancang dengan N , N -dimetilasetamida sebagai pelarut bersama. Direproduksi dengan izin. [ 96 ] Hak cipta 2024, Royal Society of Chemistry. g) Spektrum UV–vis dari anion I 3 − yang dihasilkan dalam berbagai elektrolit, sisipan menunjukkan perbedaan dalam kurungan I 2 . Direproduksi dengan izin. [ 97 ] Hak cipta 2024, Wiley-VCH GmbH. h) Nilai energi adsorpsi permukaan H 2 O, SO 4 2− , I − , dan n -butanol pada bidang Zn (002), dan i) kemampuan siklus sel penuh dengan ZS, ZSI, dan ZSI- n sebagai elektrolit pada 5 A g −1 . Direproduksi dengan izin. [ 98 ] Hak Cipta 2023, Nature Portfolio.
Selain molekul organik kecil, polimer fungsional juga mampu memodifikasi lingkungan solvasi elektrolit dengan perilaku antiproton untuk menekan penyisipan proton. Elektrolit campuran yang terdiri dari 3 m Zn(OTf) 2 dengan polietilen glikol 400 (PEG 400), secara efektif mengurangi ionisasi molekul air bebas, sehingga meminimalkan penyisipan H + ke dalam katode vanadium oksida (V2O3 ) dan menghambat pembentukan produk sampingan yang memastikan difusi Zn2+ yang cepat dan transfer muatan yang efisien. [ 91 ] Sel penuh Zn– V2O3 mempertahankan 222,8 mAh g − 1 setelah 6000 siklus pada 5 A g − 1 , dan bahkan setelah 18.000 siklus pada 20 A g −1 , yang menunjukkan peran sinergis dari desain elektrolit antiproton. Desain garam ganda adalah strategi mendalam lainnya untuk merekayasa solvasi elektrolit. Elektrolit berair dual-garam dengan memperkenalkan LiTFSI (3–7 m ) ke dalam elektrolit ZnSO4 diusulkan , yang mengubah struktur solvasi Zn 2+ , mengurangi koordinasi air dan menekan pembentukan produk sampingan [Zn(OH) 2 ] 3 (ZnSO 4 )⋅ x H 2 O (ZHS) yang biasanya menghambat transportasi Zn 2+ dalam sistem ZnSO 4 berair. [ 92 ] Elektrolit ini juga meningkatkan deposisi Zn, mengurangi akumulasi Zn mati dan mempromosikan pelapisan Zn kompak. Sel penuh Zn–VO 2 (B) dengan 1 m ZnSO 4 /5 m LiTFSI mempertahankan kapasitas 90% setelah 1000 siklus.
Selain pengendalian solvasi Zn 2+ , elektrolit hibrida meningkatkan katode berbasis vanadium terutama dengan mengatur aktivitas proton, mengurangi koinersi H + dan koinersi air, serta menstabilkan struktur katode. Selain itu, pemilihan pelarut yang wajar untuk menghambat pelarutan vanadium, mendorong pembentukan CEI pelindung, dan meningkatkan kinetika pemindahan muatan merupakan cara yang efektif untuk mencapai kapasitas tinggi dan memperpanjang masa pakai siklus.
4.2.2 Katoda Berbasis Mangan
Oksida mangan seperti MnO2 telah diselidiki paling awal dan paling banyak untuk katode AZB karena struktur terowongan atau lapisannya yang dapat disetel, keadaan valensi variabel, dan cadangan sumber daya yang melimpah. [ 99 ] Sementara katode berbasis vanadium mendapat manfaat dari strategi ini, katode berbasis mangan (oksida) menghadirkan tantangan selain dari kinetika yang lambat, degradasi struktural yang nyata dan stabilitas siklus yang buruk juga menjadi masalah. Metode elektrolit hibrida yang sederhana dan langsung yang mengintegrasikan MnSO4 dan ZnSO4 untuk mengatasi masalah seperti reaksi pelarutan Mn2 + dan evolusi oksigen, yang mendorong pembentukan katode oksida mangan yang kaya Mn2 + , menstabilkan pasangan redoks Mn. Keseimbangan antara kandungan ZnSO4 / MnSO4 dan efeknya pada pH elektrolit dan CE dipelajari secara sistematis (Gambar 6d ). [ 94 ] Selain itu, molekul organik kecil [ 100 ] dan nanomaterial fungsional [ 93 ] digunakan untuk mencegah pelarutan Mn 2+ dan menekan pengendapan underpotensial Zn. Secara khusus, Kaolinit mengurangi aktivitas air, mencegah reaksi samping pada anoda dan memastikan siklus bebas dendrit. Khususnya, di katoda, ia menstabilkan pH lokal, mencegah pembentukan MnOOH inert (Gambar 6c ), memungkinkan sel Zn–MnO 2 (α) mencapai kapasitas 348 mAh g −1 pada 0,2 A g −1 .
Seperti katode berbasis V, elektrolit hibrida meningkatkan katode berbasis Mn dengan mengatur solvasi Zn 2+ dan menekan ko-sersi H + . Namun, untuk elektroda Mn, pelarutan Mn 2+ merupakan tantangan utama. Elektrolit hibrida mengurangi hal ini dengan menstabilkan pH lokal, membentuk CEI pelindung, dan mencegah pembentukan fase Mn yang tidak aktif. Peningkatan ini memastikan siklus redoks Mn yang reversibel, stabilitas yang lebih lama, dan retensi kapasitas yang ditingkatkan.
4.2.3 Katoda Berbasis Sulfur
Dibandingkan dengan katode berbasis V dan Mn, katode berbasis S baru-baru ini menarik minat yang meningkat terhadap AZB berenergi tinggi, yang menimbulkan tantangan signifikan karena kinetika konversi yang lambat dan pelarutan sulfur. Elektrolit hibrida juga memainkan peran penting dalam menstabilkan sistem ini, meningkatkan kinerja katode sulfur dan stabilitas jangka panjangnya. Molekul fungsional kecil dan elektrolit yang mengandung S digunakan untuk mengurangi aktivitas air dan menekan pelarutan sulfur selama siklus. [ 95 , 101 ] Elektrolit ini memperluas ESW hingga ≈2,0 V, memungkinkan proses konversi sulfur yang stabil dengan energi pengikatan S 2− yang dioptimalkan (Gambar 6e ).
Spesies yodium terbukti layak untuk lebih lanjut mengkatalisis reaksi redoks sulfur pada beberapa kesempatan. Kemajuan dibuat oleh aditif ganda menggunakan N , N -dimetilasetamida (DMA) dan ZnI2 dalam elektrolit hibrida yang memberikan peningkatan keterbasahan dan mobilitas ion (Gambar 6f ) dengan kapasitas pelepasan tinggi sebesar 1453 mAh g −1 . [ 96 ] Strategi serupa, termasuk Zn(OTf) 2 dengan dimetil karbonat (DMC) dan I2 , [ 102 ] EG dan I2 menjadi elektrolit Zn(OAc) 2, [ 103 ] elektrolit hibrida tetraglime (G4)–air dengan aditif I2 , [ 104 ] juga efektif untuk mempercepat konversi sulfur, mengurangi energi aktivasi dan menurunkan polarisasi reaksi.
Elektrolit hibrida memainkan peran penting dalam mengatasi tantangan katode berbasis S dengan mengatur solvasi Zn 2+ , menstabilkan zat antara sulfur, dan mengurangi kehilangan kapasitas terkait pelarutan. Dengan memodifikasi struktur solvasi dan mengurangi aktivitas air, elektrolit ini menekan reaksi samping yang tidak diinginkan dan meningkatkan kinetika redoks sulfur. Investigasi yang lebih mendalam terhadap spesiasi sulfur yang bergantung pada pH, reaksi antarmuka, dan peran aktivitas air yang memengaruhi berbagai zat antara akan sangat penting dalam memperkuat redoks sisi katode.
4.2.4 Katoda Berbasis Halogen
Katoda berbasis halogen (seperti Cl 2 , Br 2 , dan I 2 ) memiliki aplikasi signifikan dalam penyimpanan energi skala besar, khususnya dalam konfigurasi tangki tipe aliran dan nonaliran. Namun, sistem ini menghadapi tantangan, seperti pengangkutan polihalida dan kinetika konversi yang buruk. Elektrolit hibrida adalah solusi yang menjanjikan, menggunakan aditif khusus untuk mengatasi masalah ini dan meningkatkan kinerja baterai secara keseluruhan. Misalnya, dalam baterai ZnBr 2 , tetrabutilamonium bromida (TBABr) dalam elektrolit secara efektif menekan difusi silang bromin, mengurangi pelepasan muatan sendiri dan meningkatkan CE. [ 105 ] Sel penuh ZnBr 2 menunjukkan kapasitas spesifik tinggi sebesar 297 mAh g −1 dan 99,9% CE selama 11.500 siklus. Selain itu, strategi aditif ganda yang menggabungkan Ce 3+ dan Cl − digunakan untuk meningkatkan stabilitas anoda Zn dan efisiensi katoda Br₂, mencapai kapasitas lebih dari 400 mAh setelah 5000 siklus. [ 106 ]
Dalam baterai ZnI2 , sifat padat I2 dan kelarutannya yang terbatas membuat desain elektrolit lebih menantang. Namun, dengan menggunakan penyangga pH organik (seperti piridina dan imidazol) dan IL poliiodida (PIL), pengangkutan poliiodida dan pembentukan dendrit dapat ditekan secara efektif, meningkatkan kinetika konversi I2 / I− dan stabilitas siklus jangka panjang. [ 107 ] Lebih jauh lagi, elektrolit yang dimodifikasi PEG mengganggu ikatan hidrogen dalam air, menstabilkan spesies I + bervalensi tinggi dan mendorong siklus halogen yang efisien (Gambar 6g ). [ 97 ] Pendekatan ini memungkinkan baterai ZnI2 mempertahankan operasi yang stabil pada suhu dari −40 hingga 40 °C dan mencapai 20.000 siklus pada 2 A g −1 . Strategi optimasi sinergis, menggunakan n -butanol dan MXene, [ 98 ] semakin meningkatkan stabilitas siklus, mencapai 30.000 siklus pada 5 A g −1 dan kepadatan energi 0,34 mWh cm −2 , seperti yang ditunjukkan pada Gambar 6h,i . Elektrolit hibrida inovatif ini secara efektif mengatasi tantangan tradisional katoda berbasis halogen, meningkatkan kinerja jangka panjang.
Pemahaman yang lebih mendalam tentang interaksi elektrolit–katode sangat penting untuk sepenuhnya menyadari potensi AZB, memposisikan area ini sebagai fokus penting untuk penelitian di masa mendatang. Di satu sisi, ketika memeriksa pengaruh elektrolit hibrida pada bahan katode, penting untuk mempertimbangkan kemampuannya untuk menahan kondisi operasi ekstrem, seperti tegangan tinggi dan suhu tinggi, yang penting untuk memperluas jangkauan operasional AZB. Di sisi lain, dalam mengeksplorasi lebih lanjut multifungsi mereka, berbagai bahan elektroda—di luar katode yang dibahas sebelumnya, termasuk katode organik dan bahan redoks-aktif yang baru muncul [ 108 ] —juga dapat memperoleh manfaat dari desain elektrolit hibrida yang disesuaikan.
4.3 Formulasi Elektrolit
Selain peran krusialnya dalam menstabilkan material elektrolit, elektrolit hibrida juga menawarkan peningkatan signifikan dalam metrik kinerja utama lainnya yang penting untuk aplikasi praktis, yang secara signifikan meningkatkan baterai Zn-ion. Dibandingkan dengan material elektroda padat yang menawarkan penyetelan yang relatif terbatas, elektrolit memberikan fleksibilitas yang jauh lebih besar dalam komposisi dan properti, menyetel metrik kinerja utama seperti keamanan, kepadatan energi, tegangan kerja, masa pakai, dan jendela operasional. Dengan mengurangi aktivitas air dan menstabilkan reaksi redoks tegangan tinggi, elektrolit ini memperluas ESW, memungkinkan tegangan operasional yang lebih tinggi dan mencegah dekomposisi material aktif. Selain itu, elektrolit ini memastikan kinerja yang andal di seluruh rentang suhu, meningkatkan stabilitas dan keamanan siklus. Peningkatan komprehensif ini memastikan sistem baterai berfungsi lebih efisien dalam berbagai kondisi, memperpanjang masa pakai, dan meningkatkan kinerja secara keseluruhan.
4.3.1 Ekspansi Jendela Tegangan
Salah satu tantangan utama dalam mengembangkan AZB berkinerja tinggi adalah memperluas ESW. ESW yang lebih luas tidak hanya memungkinkan voltase operasional yang lebih tinggi, yang meningkatkan kepadatan energi, tetapi juga mengurangi reaksi samping dan meningkatkan masa pakai baterai secara keseluruhan. Berdasarkan strategi substitusi ligan ( Gambar 7a ), dengan memperkenalkan ligan organik seperti asetonitril [ 109 ] dan butilpiridina, [ 110 ] struktur solvasi dapat disesuaikan untuk menghambat aktivitas air, dengan demikian meningkatkan konduktivitas elektrolit dan mendorong pembentukan SEI, yang dianggap sebagai metode efektif untuk memperluas ESW, melampaui batas oksidasi elektrolit berair yang umum (Gambar 7b ). Selain itu, elektrolit polimer padat dirancang dengan memperkenalkan poliakrilonitril (PAN) ke dalam Zn(OTf) 2 , elektrolit polimer dengan 70% garam seng mencapai ESW sebesar 9,35 V, salah satu yang tertinggi yang dilaporkan untuk baterai ion Zn (Gambar 7c ). [ 111 ] Dalam mempertimbangkan jendela tegangan, kompatibilitas suhu dan toleransi elektrolit juga merupakan hal yang perlu diperhatikan untuk memenuhi kebutuhan pasar peralatan penyimpanan energi.
Gambar 7
Buka di penampil gambar
Kekuatan Gambar
a) Ilustrasi yang menunjukkan bagaimana strategi substitusi ligan untuk meningkatkan ESW dan konduktivitas ionik elektrolit. Direproduksi dengan izin. [ 109 ] Hak cipta 2022, Wiley-VCH GmbH. b) ESW elektrolit dengan konsentrasi garam yang sama dalam air, asetonitril, dan pelarut hibrida. Direproduksi dengan izin. [ 109 ] Hak cipta 2022, Wiley-VCH GmbH. c) Skema struktur tersolvasi dan transpor ion “garam dalam polimer”. Direproduksi dengan izin. [ 111 ] Hak cipta 2024, Wiley-VCH GmbH. d) Diagram skema mekanisme pengisian/pengosongan dalam elektrolit ZAD4. Direproduksi dengan izin. [ 112 ] Hak cipta 2025, Cell Press. e) Jumlah ikatan H molekul H 2 O yang diperoleh dari simulasi MD dalam berbagai elektrolit kosolven. Direproduksi dengan izin. [ 113 ] Hak Cipta 2022, Elsevier BV f) Evaluasi struktur solvasi berbagai elektrolit dan sifat kimia molekul 18-crown-6 dan 1,2-PG. Direproduksi dengan izin. [ 113 ] Hak Cipta 2022, Elsevier BV g,h) Diagram skema yang mengilustrasikan transpor ion Zn antara elektroda dan elektrolit dalam elektrolit bare/entropi tinggi. Direproduksi dengan izin. [ 114 ] Hak Cipta 2024, Wiley-VCH GmbH. i) Spektrum FTIR elektrolit hibrida dalam mode transmisi melalui sel CaF2 , dan j) Kapasitas spesifik pada berbagai suhu dengan rapat arus 0,1 A g −1 . Direproduksi dengan izin. [ 59 ] Hak Cipta 2020, Royal Society of Chemistry.
4.3.2 Perpanjangan Kisaran Suhu
Dengan memperkenalkan titik leleh rendah, pelarut toleransi suhu tinggi, aktivitas air diatur untuk memenuhi konduktivitas ionik dan stabilitas elektrolit pada suhu rendah dan tinggi, dan untuk menghambat reaksi samping. Misalnya, elektrolit hibrida berbasis Zn(OAc) 2 dengan DMSO (ZAD4) meningkatkan kinerja suhu rendah, yang memungkinkan operasi pada −20 °C dengan CE awal 97,7% dan lebih dari 5600 jam siklus hidup (Gambar 7d ). [ 112 ] Demikian pula, elektrolit anion ganda Zn(OAc) 2 dan Zn(OTf) 2 mengurangi titik beku hingga di bawah −40 °C dan memperpanjang operasi hingga 60 °C, meningkatkan kinerja anoda Zn dengan menstabilkan solvasi dan dinamika antarmuka. [ 27 ] Selain itu, IL [BMIM]OTf telah menunjukkan sifat antibeku yang sangat baik, menurunkan titik beku hingga −62 °C dan mencapai siklus stabil selama lebih dari 1000 jam pada suhu −40 °C (Gambar 7e,f ). [ 115 ]
Pada suhu yang sangat rendah, mengoptimalkan aktivitas air dan interaksi ikatan-H adalah poin-poin utama. Misalnya, penambahan 1,2-propanediol dan 18-crown-6 ke elektrolit berbasis ZnCl2 mencegah nukleasi es, sehingga memungkinkan operasi yang stabil pada suhu -50 °C (Gambar 7g,h ). [ 113 ] Elektrolit hibrida seperti HE-30 entropi tinggi, yang menggabungkan DMSO, etil asetat, dan EG, bekerja dengan baik pada suhu -30 °C, berputar secara stabil selama lebih dari 2500 jam. Selain itu, elektrolit berbasis EG menunjukkan peningkatan kinerja pada suhu -40 °C dengan konduktivitas ionik 6,9 mS cm -1 dan stabilitas jangka panjang yang sangat baik (Gambar 7i,j ). [ 114 ] Pendekatan lain, seperti elektrolit “air dalam organik”, [ 116 ] memperluas jendela elektrokimia dan menjaga stabilitas pada rentang suhu yang luas, dari −20 °C hingga 50 °C. Strategi ini menyoroti potensi elektrolit hibrida untuk membuat baterai Zn-ion layak untuk aplikasi dunia nyata dengan memastikan kinerja yang andal pada suhu di bawah nol dan suhu tinggi.
4.3.3 Degradasi dan Keamanan Elektrolit
Meskipun AZB dianggap lebih aman, penambahan pelarut organik dapat membahayakan keamanan elektrolit, terutama ketika pelarut organik membentuk proporsi yang signifikan dari komposisi elektrolit. Untuk mengatasi hal ini, pelarut organik tahan api seperti polietilen glikol, [ 117 ] etilen glikol, [ 118 ] dan kappa-karagenan dan kitosan yang terikat silang digunakan dalam elektrolit hibrida untuk membuat campuran yang tidak mudah terbakar. Namun , meskipun ada langkah-langkah keamanan ini, ketidakstabilan dalam elektrolit selama siklus pengisian dan pengosongan, yang mengakibatkan reaksi evolusi hidrogen dan oksigen, masih dapat menyebabkan masalah seperti pembengkakan atau bahkan ledakan. Sementara beberapa penelitian telah mengusulkan desain baterai tidak tertutup, penelitian tentang sistem seperti itu dalam AZB, khususnya dalam elektrolit hibrida organik, masih terbatas dan memerlukan eksplorasi lebih lanjut.
Yang terpenting, elektrolit hibrida telah menunjukkan potensi signifikan dalam meningkatkan kinerja dan keamanan AZIB pada suhu rendah dengan mengoptimalkan sifat elektrolit. Dengan mengintegrasikan komponen organik dan berair, elektrolit ini secara efektif menstabilkan antarmuka elektroda, memperluas ESW, dan meningkatkan parameter utama seperti konduktivitas ionik dan stabilitas siklus. Sementara kemajuan substansial telah dibuat dalam menekan pembekuan elektrolit dan mengurangi reaksi samping pada suhu di bawah nol, penelitian di masa mendatang harus difokuskan pada penyempurnaan lebih lanjut struktur solvasi dan mengeksplorasi sistem pelarut baru untuk meningkatkan stabilitas dan konduktivitas pada suhu yang sangat rendah. Selain itu, kinerja suhu tinggi masih relatif kurang dieksplorasi, yang memerlukan penyelidikan terhadap elektrolit tahan termal yang mencegah penguapan pelarut, menjaga integritas antarmuka, dan memastikan stabilitas siklus jangka panjang. Memajukan formulasi elektrolit untuk ketahanan suhu tinggi dan rendah akan sangat penting untuk memperpanjang umur operasional dan efisiensi AZB di lingkungan dunia nyata yang menuntut.
4.4 Desain Baterai Secara Keseluruhan
Desain dan optimalisasi AZB memerlukan regulasi sinergis dari sifat elektroda dan elektrolit, karena interaksi keduanya secara mendasar menentukan kinerja, stabilitas, dan kelayakan praktis baterai. Oleh karena itu, kami akan menganalisis lebih lanjut adaptasi struktural, biokompatibilitas, dan pemisahan fase terkendali berdasarkan desain baterai secara keseluruhan di sini.
4.4.1 Mengakomodasi Adaptasi Struktural
Elektrolit hibrida berbasis gel telah meningkatkan kinerja mekanis AZB berair secara signifikan dengan meningkatkan kemampuan adaptasi strukturalnya. Peningkatan ini meliputi peningkatan kekuatan mekanis, konduktivitas ionik, dan stabilitas termal, yang memungkinkan baterai menahan deformasi mekanis tanpa mengorbankan kinerjanya. Misalnya, elektrolit hidrogel komposit struktural dibuat dengan mengintegrasikan mikro platelet alumina ke dalam matriks polimer alginat yang diikat silang Ca dan poliakrilamida yang diikat silang secara kovalen. [ 5 ] Desain ini meningkatkan kekuatan tarik gel (2,2 MPa) dan modulus elastisitas (6,1 MPa), sambil mempertahankan konduktivitas ionik yang tinggi (17 mS cm −1 pada 25 °C). Penggabungan platelet alumina meningkatkan transportasi ion, menekan pembentukan dendrit, dan memastikan stabilitas elektrokimia yang unggul, bahkan di bawah suhu ekstrem ( Gambar 8a,b ). Kemajuan penting lainnya adalah pengembangan elektrolit hidrogel amfifilik ultra-tipis yang menggabungkan PAN hidrofobik dengan polivinil alkohol (PVA) hidrofilik, mencapai peningkatan kekuatan tarik sebesar 282% dan konduktivitas ionik yang tinggi (17,4 mS cm −1 ). [ 120 ] Elektrolit ini menunjukkan stabilitas elektrokimia yang sangat baik dan kemampuan untuk mencegah pertumbuhan dendrit, mendukung stabilitas siklus jangka panjang (Gambar 8c ). Desain baterai seperti kertas tetap beroperasi bahkan setelah dilipat, menyoroti fleksibilitas elektrolit yang luar biasa dan ketahanan mekanis (Gambar 8d ). Perkembangan ini menggarisbawahi peran penting elektrolit hibrida dalam meningkatkan kemampuan beradaptasi mekanis dan kinerja keseluruhan baterai Zn-ion. Penting untuk dicatat bahwa, dalam desain elektrolit hibrida berbasis gel, toleransi suhu harus dipertimbangkan secara menyeluruh untuk memenuhi persyaratan berbagai skenario komersialisasi di masa mendatang.

Gambar 8
Buka di penampil gambar
Kekuatan Gambar
a) Gambaran skema elektrolit hidrogel komposit struktural, pelat alumina berlapis dalam matriks hidrogel padat memungkinkan perpindahan ion Zn dan pengendapan Zn yang seragam. Direproduksi dengan izin. [ 5 ] Hak cipta 2024, Wiley-VCH GmbH. b) Kemampuan laju sel elektrolit hidrogel komposit struktural pada suhu yang berbeda. Direproduksi dengan izin. [ 5 ] Hak cipta 2024, Wiley-VCH GmbH. c) Ilustrasi skema hidrogel C-PVA/PAN dengan jaringan polimer hidrofobik–hidrofilik ganda. Direproduksi dengan izin. [ 120 ] Hak cipta 2024, Royal Society of Chemistry. d) Baterai Zn seperti kertas terstruktur origami Miura untuk memberi daya pada sensor suhu/kelembapan selama baterai dibuka/dilipat. Direproduksi dengan izin. [ 120 ] Hak cipta 2024, Royal Society of Chemistry. e) Retensi kapasitas baterai Zn fleksibel dalam berbagai deformasi perangkat. Direproduksi dengan izin. [ 121 ] Hak cipta 2022, Wiley-VCH GmbH. f) Ringkasan jarak (L) di antara domain nanokristalin sebagaimana diukur dari analisis SAXS untuk berbagai sampel elektrolit hidrogel, dan g) foto tikus yang mengenakan perangkat elektronik Zn yang dapat dikenakan untuk manajemen luka (skala batang: 1 mm). Direproduksi dengan izin. [ 122 ] h) Evolusi area luka relatif dalam persentase untuk kelompok kontrol dan stimulasi listrik. Direproduksi dengan izin. [ 122 ] Hak cipta 2024, Wiley-VCH GmbH. i) Skema baterai “terbalik” berlapis, bebas membran. Direproduksi dengan izin. [ 123 ] Hak cipta 2021, American Chemical Society. j) Retensi kapasitas baterai bifasik nirmembran Z|T 0,5 m pada hari ke-0, 30, 60, 90, dan 120 batang kesalahan menunjukkan rata-rata ± simpangan baku, ukuran sampel ( n ) = 3. Direproduksi dengan izin. [ 124 ] Hak cipta 2024, Wiley-VCH GmbH. k) Kinerja siklus sel kantong Zn|SPSE|V 2 O 5 pada 0,5 A g −1 dalam pengulangan rollover. Direproduksi dengan izin. [ 125 ] Hak cipta 2025, American Chemical Society.
4.4.2 Aplikasi Biokompatibel/Dapat Dipakai
Selain kemampuan adaptasi struktural, biokompatibilitas, stabilitas jangka panjang, dan keamanan elektrolit campuran telah menjadi isu yang sama pentingnya. Memastikan toksisitas minimal, stabilitas elektrokimia, dan ketahanan terhadap degradasi dalam kondisi fisiologis adalah kunci untuk mengintegrasikan AZB ke dalam teknologi yang dapat dikenakan dan ditanamkan generasi berikutnya. Kemajuan terkini mencakup elektrolit biogel hibrida yang terdiri dari karagenan dan keratin wol, [ 121 ] yang mengatur transpor ion Zn 2+ , menekan reaksi samping, dan meningkatkan stabilitas siklus jangka panjang (lebih dari 1900 jam pada 0,5 mA cm −2 ), sekaligus memastikan biokompatibilitas, yang cocok untuk perangkat yang dapat dikenakan (Gambar 8e ). Selain itu, elektrolit hidrogel berdasarkan PVA dan asam poliakrilat menunjukkan jalur transpor ion searah (Gambar 8f ), meningkatkan konduktivitas ionik dan stabilitas siklus, dan menunjukkan harapan untuk aplikasi dalam elektronik yang dapat dikenakan dan penyembuhan luka (Gambar 8g,h ). [ 122 ]
Pemilihan material elektrolit, integritas desain keseluruhan, dan keamanan harus dievaluasi secara cermat untuk memastikan kompatibilitas dengan aktivitas manusia di dunia nyata sekaligus menjaga stabilitas jangka panjang. Akibatnya, penelitian semacam itu relatif lebih sedikit dieksplorasi dibandingkan penelitian sebelumnya dan memerlukan pengembangan lebih lanjut.
4.4.3 Pemisahan Fase Terkendali
Bahasa Indonesia: Berdasarkan kemajuan dalam elektrolit hibrida, konsep lain yang sedang naik daun untuk meningkatkan kinerja baterai Zn-ion adalah konsep pemisahan fasa terkendali. Dua fasa berbeda sengaja direkayasa untuk mengoptimalkan konduktivitas ionik, integritas struktural, dan kinerja elektrokimia untuk mewujudkan fungsi/kinerja yang tidak dapat dicapai oleh satu fasa elektrolit. Biasanya, pendekatan ini memanfaatkan air dan non-air untuk mengoptimalkan transportasi ion dan mencegah reaksi samping yang tidak diinginkan tanpa memerlukan membran fisik. Contoh utama adalah baterai Zn/fenotiazin (PTZ) bebas membran, yang memanfaatkan pemisahan fasa terkendali antara anolit Zn 2+ air dan katolit PTZ non-air. [ 123 ] Baterai menunjukkan kepadatan energi tinggi (9,72 Ah L −1 ) dan siklus stabil selama 202 siklus dengan penurunan kapasitas minimal (0,103% per siklus). Penggunaan turunan PTZ memengaruhi kelarutan dan retensi fasa, dengan PTZ N -oktil memberikan kinerja optimal. Manfaat sistem ini meliputi pengurangan penguapan elektrolit dan peningkatan stabilitas elektrokimia, tetapi pembentukan dendrit Zn dan volatilitas pelarut tetap menjadi tantangan yang memerlukan pengoptimalan lebih lanjut (Gambar 8i ).
Kasus signifikan lainnya adalah elektrolit hibrida untuk baterai ZnBr2 bifasik , yang berfokus pada meminimalkan perpindahan Br2 dan pelepasan muatan sendiri. [ 124 ] Sistem ini menggunakan fase ZnBr2 berair dan fase diklorometana organik yang mengandung tetrabutilamonium bromida (TBABr). Pemisahan fase berhasil mencegah migrasi bromin ke anoda seng, menghasilkan retensi tegangan sirkuit terbuka selama 120 hari dan retensi kapasitas 95,5%. Baterai juga mempertahankan efisiensi Coulombik ≈100% selama 500 siklus, dengan desain fase ganda membantu memperpanjang masa pakai siklus sambil mengurangi pelepasan muatan sendiri (Gambar 8j ). Demikian pula, baterai ZnI2 bifasik dengan elektrolit hibrida menunjukkan kepadatan energi rekor (21,7 Ah L −1 ) dan stabilitas siklus, sambil menekan pertumbuhan dendrit Zn. Selain itu, baterai air berlapis sendiri juga dapat dibuat dengan IL berbasis imidazolium, [ 126 ] pasangan redoks seng–ferosena, [ 127 ] Aliquat 336, [ 128 ] katolit organik (TEMPO dalam tetraetilen glikol dimetil eter), [ 129 ] dan elektrolit N , N -dimetil trifluoroasetamida, [ 125 ] memberikan kinerja yang menjanjikan (Gambar 8k ).
Kemajuan ini menunjukkan potensi pemisahan fase yang terkontrol untuk meningkatkan kinerja baterai Zn-ion baik dalam hal stabilitas maupun efisiensi. Sementara pemisahan fase menawarkan manfaat yang signifikan, termasuk masa pakai baterai yang lebih lama dan kepadatan energi yang lebih tinggi, tantangan seperti pembentukan dendrit dan pencampuran fase dalam kondisi tertentu tetap ada, yang memerlukan pengoptimalan lebih lanjut. Meskipun demikian, integrasi strategi pemisahan fase menandai langkah penting menuju peningkatan keandalan dan penerapan baterai Zn-ion dalam berbagai aplikasi dunia nyata.
4.5 Peluang Pembelajaran Mesin dan Kecerdasan Buatan
Penerapan pembelajaran mesin (ML) dan kecerdasan buatan (AI) di bidang ilmu material terus berkembang. [ 130 ] Hal ini tidak hanya mempercepat proses penyaringan dan desain material tetapi juga memungkinkan penemuan pola dan hubungan potensial dalam sejumlah besar data, sehingga mengoptimalkan kinerja elektrolit multikomponen secara keseluruhan, terutama untuk elektrolit hibrida. Metode tradisional untuk mendesain elektrolit hibrida umumnya bergantung pada studi eksperimental dan panduan empiris dengan banyak percobaan dan kesalahan yang membosankan. Dengan menganalisis sejumlah besar data eksperimen dan komputasi, ML dapat menemukan korelasi potensial secara efisien di antara komposisi/struktur material, kondisi operasi, dan kinerja elektrolit yang diformulasikan, sehingga memandu pengembangan dan pengoptimalan material baru. Misalnya, teknik ML seperti Support Vector Machines, [ 131 ] Pohon Keputusan, [ 132 ] dan Jaringan Syaraf [ 133 ] dapat menganalisis material elektrolit hibrida yang ada dan memprediksi bagaimana komposisi yang berbeda memengaruhi sifat elektrolit, mengurangi eksperimen yang berlebihan dan mempercepat penemuan elektrolit berkinerja tinggi. Selain itu, algoritme dalam ML dapat dioptimalkan secara efisien melalui ruang desain multidimensi, yang secara otomatis menyesuaikan komposisi dan formulasi elektrolit untuk menemukan konfigurasi optimal dengan cepat. Metode ini sangat cocok untuk sistem elektrolit hibrida yang kompleks, yang memungkinkan pengoptimalan berbagai komponen (misalnya, IL, polimer, dan pelarut) untuk memaksimalkan sifat elektrolit.
Dengan melatih model ML, para peneliti dapat dengan cepat dan tepat memprediksi sifat fisik dan elektrokimia seperti konduktivitas ionik, stabilitas termal, dan stabilitas elektrokimia, yang selanjutnya memandu pengoptimalan komposisi elektrolit. [ 134 ] Keuntungan lain dari ML adalah kemampuannya untuk berintegrasi dengan data eksperimen dan mengoptimalkan model secara berulang untuk akurasi prediksi yang tinggi. Setiap penambahan data eksperimen dapat digunakan untuk memperbarui model, yang mencerminkan kondisi dunia nyata dengan lebih tepat. Umpan balik antara eksperimen dan simulasi memungkinkan ML untuk mempercepat desain material dan terus menyempurnakan kinerja elektrolit melalui validasi eksperimen dan penyesuaian waktu nyata.
Seiring terus berkembangnya teknologi ini, teknologi ini tidak diragukan lagi akan memainkan peran utama dalam memajukan bidang penyimpanan energi dan mewujudkan baterai generasi berikutnya. Oleh karena itu, ML dan AI akan mendorong teknologi elektrolit hibrida menuju solusi yang lebih efisien dan andal.
5 Tantangan dan Perspektif
Elektrolit hibrida telah memperkenalkan kemajuan transformatif dalam desain baterai Zn-ion, meningkatkan konduktivitas ionik, stabilitas antarmuka, dan fleksibilitas mekanis serta mengatasi masalah yang muncul seperti biokompatibilitas, stabilitas jangka panjang, dan keamanan. Sementara penelitian ekstensif telah didedikasikan untuk kemampuan adaptasi elektrolit untuk fungsi-fungsi yang disebutkan di atas yang menargetkan setiap bagian baterai, modifikasi—baik dalam struktur, kimia solvasi, atau pemisahan fase—pada akhirnya harus meningkatkan kinerja inti baterai, termasuk stabilitas siklus, kepadatan energi, keluaran tegangan, dan masa pakai operasional. Karena tidak ada karakterisasi komposisi elektrolit langsung, karakterisasi tidak langsung yang tercermin dari kinerja baterai, bersama dengan kalkulasi teoritis (terutama teori fungsi kerapatan dan simulasi dinamika molekul ab initio adalah teknik evaluasi utama), ada banyak ruang untuk studi sistematis tentang kandungan dan konsentrasi elektrolit dalam rentang yang lebih sempit dan masuk akal. Di masa mendatang, untuk mencapai promosi luas baterai seng berbasis air dalam aplikasi skala besar, masih perlu untuk mengeksplorasi secara mendalam mekanisme dan pertukaran antara desain elektrolit dan kinerja baterai dan mengatasi beberapa hambatan komersialisasi utama yang ada saat ini ( Gambar 9 ).
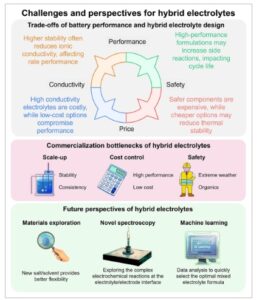
Gambar 9
Buka di penampil gambar
Kekuatan Gambar
Tantangan dan perspektif elektrolit hibrida untuk AZB praktis.
5.1 Pertukaran Kinerja Baterai dan Desain Elektrolit Hibrida
Pertukaran antara desain elektrolit hibrida dan kinerja baterai adalah proses pengoptimalan multivariabel yang melibatkan konduktivitas, stabilitas, keamanan, biaya, dan dampak lingkungan, dan desain akhir perlu dibuat sesuai dengan persyaratan aplikasi spesifik.
Konduktivitas elektrolit hibrida merupakan salah satu faktor inti kinerja baterai. Semakin baik konduktivitasnya, semakin tinggi pula efisiensi transmisi arus baterai selama pengisian dan pengosongan daya, dan kepadatan daya serta siklus hidup baterai juga dapat ditingkatkan. Akan tetapi, elektrolit hibrida yang sangat konduktif sering kali mengandung lebih banyak jenis pelarut dan lebih mahal, yang dapat menyebabkan peningkatan biaya.
Stabilitas elektrolit hibrida sangat penting bagi keamanan baterai. Elektrolit hibrida harus stabil dalam rentang suhu dan tegangan yang luas untuk menghindari dekomposisi dan pembentukan gas dalam kondisi seperti pengisian berlebih, pengosongan berlebih, atau suhu tinggi, yang mengakibatkan akumulasi gas yang mudah terbakar dan pembentukan zat beracun. Untuk meningkatkan stabilitas, mungkin perlu menggunakan pelarut dan garam dengan stabilitas kimia yang lebih baik, tetapi ini dapat mengurangi konduktivitas atau meningkatkan biaya.
Jendela tegangan elektrolit hibrida menentukan rentang tegangan maksimum di mana baterai dapat beroperasi. Untuk meningkatkan kepadatan energi baterai dan meningkatkan keragaman elektroda katode yang cocok, biasanya perlu untuk memperluas jendela tegangan elektrolit hibrida. Namun, hal ini dapat menyebabkan berkurangnya stabilitas elektrolit pada tegangan tinggi, yang pada gilirannya memengaruhi keamanan dan siklus hidup baterai. Untuk meningkatkan stabilitas tegangan tinggi, mungkin perlu menambahkan penstabil ke elektrolit hibrida atau memilih pelarut yang tahan terhadap tegangan tinggi, tetapi ini juga akan meningkatkan kompleksitas dan biaya desain.
Kinerja suhu rendah elektrolit hibrida sangat penting untuk aplikasi baterai di lingkungan dingin. Meskipun elektrolit hibrida dapat secara efektif memperluas rentang suhu pengoperasian, namun, untuk mempertahankan kinerja suhu rendah yang andal, mungkin perlu menggunakan pelarut dengan titik beku yang lebih rendah, tetapi saat menggunakan pelarut tersebut, perlu mempertimbangkan stabilitas elektrokimia, biaya, dan faktor-faktor lainnya.
Meskipun elektrolit berair memiliki keunggulan karena ramah lingkungan. Akan tetapi, untuk elektrolit hibrida, penggunaan pelarut nonair perlu mempertimbangkan bahaya lingkungan dan mudahnya degradasi. Oleh karena itu, saat merancang elektrolit hibrida, perlu mempertimbangkan dampak lingkungannya, seperti memilih bahan kimia yang lebih mudah terurai atau tidak beracun, yang biasanya meningkatkan biaya produksi.
Karena reaksi antarmuka yang kompleks antara elektrolit dan material elektroda, berbagai sifat elektrokimia baterai saling terkait erat, dan hubungannya rumit. Oleh karena itu, saat merancang elektrolit hibrida, berdasarkan mekanisme dasar reaksi baterai, perlu mempertimbangkan secara komprehensif pengaruh pengenalan pelarut pada berbagai sifat (reaksi samping, stabilitas elektrolit, kemampuan beradaptasi suhu, konduktivitas, dll.).
Desain elektrolit hibrida merupakan proses optimasi multivariabel, dan peningkatan satu properti sering kali mengorbankan properti lainnya, sehingga para peneliti harus mempertimbangkan konduktivitas ionik, stabilitas elektrokimia, viskositas, stabilitas termal, keamanan, dan keselamatan berdasarkan kebutuhan aplikasi spesifik (seperti kepadatan energi yang lebih tinggi, masa pakai yang lebih lama, keamanan yang lebih baik, atau biaya yang lebih rendah), yang diseimbangkan dengan cermat. Penelitian di masa mendatang harus memprioritaskan regulasi sinergis dari properti elektrolit dan elektroda, memastikan bahwa inovasi dalam elektrolit hibrida berkontribusi langsung pada efisiensi, daya tahan, dan kelayakan komersial baterai Zn-ion.
5.2 Kendala Komersialisasi
Sistem elektrolit hibrida telah mencapai hasil yang menjanjikan di laboratorium. Akan tetapi, masih ada beberapa tantangan untuk penerapan elektrolit hibrida dalam skala besar, terutama dalam produksi skala besar, pengendalian biaya, dan pengulangan. Dibandingkan dengan strategi berbasis aditif—yang umumnya lebih mudah untuk aplikasi industri—elektrolit hibrida menawarkan fleksibilitas dan penyetelan desain yang lebih baik serta stabilitas jangka panjang yang lebih tinggi. Struktur kimianya dirancang untuk kompatibilitas pelarut, yang memungkinkan standarisasi formulasi dan produksi volume besar. Sementara aditif hemat biaya dan digunakan dalam jumlah kecil, efeknya sering kali terbatas pada pengaturan antarmuka, tidak secara signifikan meningkatkan sifat elektrolit secara keseluruhan. Di sisi lain, elektrolit hibrida dapat membentuk kembali struktur solvasi, yang menghasilkan penekanan reaksi samping dan peningkatan sifat elektrokimia. Output energi yang lebih besar per unit biaya atau volume dapat disediakan untuk elektrolit hibrida, sementara stabilitas siklus jangka panjang yang unggul dapat dicapai secara bersamaan. Aditif dapat habis atau berpindah dari waktu ke waktu, mengurangi efektivitasnya, sementara elektrolit hibrida memanipulasi antarmuka yang stabil melalui pelarut primer dan sekunder. Selain itu, elektrolit hibrida menunjukkan ketahanan rekayasa yang lebih baik karena polaritas, viskositas, dan lingkungan koordinasinya yang dapat disesuaikan, dalam kondisi beban tinggi atau pelepasan dalam. Meskipun beberapa tantangan seperti kompleksitas komposisi dan sistem evaluasi lingkungan, kesehatan, dan keselamatan yang tidak lengkap masih ada, kemajuan dalam penyaringan pelarut, formulasi otomatis, dan pengencer ramah lingkungan dengan cepat mempersempit kesenjangan menuju komersialisasi.
Meskipun AZB memiliki tingkat keamanan yang lebih tinggi dibandingkan dengan baterai lithium-ion, keamanan elektrolit hibrida belum dapat diabaikan. Elektrolit hibrida, termasuk pelarut non-air, dapat menimbulkan masalah stabilitas dan manajemen termal, saat sel baterai dioperasikan dalam kondisi ekstrem. Oleh karena itu, cara memastikan keamanan elektrolit campuran untuk aplikasi skala besar dan lebih meningkatkan kemampuan adaptasinya dalam lingkungan yang keras seperti suhu tinggi harus dipertimbangkan untuk pengembangan di masa mendatang. Risiko kebakaran selama pengoperasian baterai, terutama dalam sistem skala besar, perlu dikurangi dengan mengembangkan elektrolit atau IL yang tidak mudah terbakar. Dengan menyingkirkan zat cair organik dan mengembangkan elektrolit berbasis padat atau gel, masalah mudah terbakar dapat diatasi. Selain itu, pemanfaatan pelarut berbasis bio atau biodegradable dapat mencegah toksisitas yang terkait dengan zat organik. Sistem manajemen baterai yang canggih dapat diimplementasikan untuk memantau dan mengatur tegangan, arus, dan suhu setiap sel untuk mencegah pengisian daya berlebih, panas berlebih, atau korsleting. Oleh karena itu, kombinasi inovasi material, regulasi keselamatan tingkat lanjut, kontrol manufaktur yang presisi, dan sistem manajemen yang lebih baik sangat penting untuk komersialisasi dan aplikasi praktis AZB.
5.3 Perspektif Masa Depan
Keunggulan utama elektrolit hibrida adalah kemampuannya untuk mengoptimalkan konduktivitas, stabilitas, dan kinerja elektrokimia baterai hanya dengan menggunakan berbagai komponen elektrolit, yang memiliki potensi besar. Dari pengoptimalan kinerja elektrolit, pengendalian biaya, peningkatan keamanan, hingga peningkatan keberlanjutan dan teknologi daur ulang, penelitian di masa mendatang akan berfokus pada isu-isu utama ini. Melalui eksplorasi garam dan pelarut baru, konduktivitas dan kemampuan adaptasi suhu elektrolit dapat ditingkatkan lebih lanjut tanpa mengurangi stabilitas baterai, yang akan memberikan fleksibilitas operasional yang lebih besar bagi AZB, terutama pada suhu ekstrem. Selain itu, dengan dukungan karakterisasi lanjutan di masa mendatang, eksplorasi lebih lanjut tentang reaksi elektrokimia kompleks pada antarmuka elektrolit elektroda, dan eksplorasi mekanisme pembentukan SEI dan penurunan kinerja baterai akan membantu memandu pengembangan elektrolit hibrida berkinerja tinggi generasi baru. Menghadapi persyaratan produksi komersial skala besar, teknologi masa depan harus berfokus pada peningkatan stabilitas formulasi elektrolit, keamanan, biaya, dan otomatisasi proses produksi, sehingga dapat memastikan efisiensi tinggi dan biaya rendah dalam produksi skala besar. Dengan meningkatkan kinetika reaksi elektrokimia, konduktivitas ionik, stabilitas elektrolit, dan sifat-sifat elektrolit lainnya di lingkungan suhu rendah dan tinggi, hal ini dapat mendukung kinerja tinggi baterai seng berbasis air di area dingin atau suhu tinggi. Selain itu, pengenalan pembelajaran mesin akan memberikan panduan yang lebih akurat untuk pengoptimalan AZB. Melalui analisis data dan pengoptimalan algoritmik, pembelajaran mesin dapat membantu dengan cepat memilih formulasi elektrolit campuran yang optimal, memprediksi stabilitas jangka panjang kinerja baterai, dan membuat pertukaran yang wajar antara kinerja. Dengan cara ini, tidak hanya penelitian dan pengembangan bahan dan desain baterai dapat dipercepat, tetapi efisiensi dan konsistensi produksi baterai juga dapat ditingkatkan secara efektif.
Singkatnya, kemajuan signifikan telah dicapai dengan mempelajari berbagai jenis elektrolit hibrida. Namun, eksplorasi lebih lanjut masih diperlukan untuk mengatasi reaksi antarmuka yang kompleks, trade-off antara berbagai kinerja baterai, dan persyaratan untuk komersialisasi skala besar di masa mendatang. Berdasarkan kimia elektrolit, makalah ini merangkum pencapaian relevan dari berbagai jenis elektrolit hibrida, yang bertujuan untuk memberikan wawasan baru untuk meningkatkan kinerja, masa pakai, biaya rendah, dan komersialisasi AZB skala besar. Melalui desain komposisi elektrolit yang tepat dan penerapan berbagai strategi, AZB masa depan diharapkan menonjol dalam berbagai aplikasi penyimpanan energi. Meskipun masih banyak hambatan teknis, dengan pengembangan berbagai metode dan kemajuan berkelanjutan dalam teknologi pengoptimalan elektrolit, elektrolit hibrida diharapkan memainkan peran yang semakin penting dalam bidang penyimpanan energi.

