
ABSTRAK
Libidibia ferrea digunakan di banyak bagian Brasil untuk berbagai kondisi, seperti peradangan, gangguan pernapasan, nyeri otot, dan masalah gastrointestinal. Studi ini mengevaluasi kimia dan aktivitas penghambatan antioksidan dan asetilkolinesterase (AChE) dari ekstrak L. ferrea . Ekstrak hidroetanol dari daun (ELLF) dan kulit kayu (EBLF) diperoleh dengan maserasi, sedangkan fraksi metanol dari biji (MFLF) disiapkan dengan ekstraksi Soxhlet dan minyak atsiri dari bunga (EOLF) diekstraksi dengan hidrodistilasi. Aktivitas antioksidan dievaluasi dengan membersihkan radikal 2,2-difenil-1-pikrilhidrazil dan 2,2′-azino-bis(asam 3-etilbenzotiazolin-6-sulfonat), dan penghambatan AChE menggunakan metode Ellman. ELLF, EBLF, dan MFLF dikarakterisasi dengan kromatografi cair kinerja tinggi yang menunjukkan keberadaan asam galat, asam klorogenat, katekin, asam kafeat, rutin, dan asam ellagik. EOLF dan MFLF menunjukkan kandungan tanin yang tinggi dan menunjukkan efek antioksidan dan penghambatan AChE yang serupa dengan standar. Docking molekuler mengungkapkan bahwa (Z)-9-tetradecenyl asetat, senyawa utama EOLF yang diidentifikasi dengan kromatografi gas/spektrometri massa, berinteraksi dengan AChE di tempat yang sama dengan galantamin. Temuan ini menunjukkan bahwa L. ferrea memiliki potensi terapeutik yang menjanjikan untuk mengobati penyakit terkait asetilkolin seperti Alzheimer.
Abstrak Grafis
1 Pendahuluan
Libidibia ferrea (Mart. Ex Tul.) LPQueiroz, sebelumnya dikenal sebagai Caesalpinia ferrea adalah spesies pohon asli Brasil, yang termasuk dalam famili Fabaceae. Di Brasil, spesies ini dikenal dengan beberapa nama umum, seperti Jucá, Pau-ferro, Pau-ferro-verdadeiro, Pau-ferro-do-sertão, dan lain-lain. Pohon ini tersebar luas di wilayah tropis dan subtropis Brasil, terutama ditemukan di bioma Caatinga dan Cerrado. L. ferrea digunakan di banyak bagian Brasil untuk berbagai kondisi, seperti peradangan, gangguan pernapasan, nyeri otot, dan masalah gastrointestinal [ 1 , 2 ]. Kulit kayu, akar, dan daun tanaman ini sering digunakan dalam bentuk teh, ekstrak, dan produk herbal lainnya [ 3 ]. Di wilayah Amazon di Brasil, buah L. ferrea banyak digunakan sebagai obat kumur antimikroba untuk infeksi mulut, melalui persiapan tingtur alkohol dengan bubuk buah kering [ 4 ].
L. ferrea tidak tercantum dalam daftar spesies flora Brasil yang terancam punah, menurut Ordonansi 443/2014, dari Kementerian Lingkungan Hidup, yang diterbitkan dalam Lembaran Negara Resmi Uni pada tanggal 18 Desember 2014 [ 5 ]. Spesies ini juga tidak termasuk dalam daftar merah spesies yang terancam punah, yang diterbitkan oleh IUCN Red List of Threatened Species 2019 [ 6 ]. Dengan demikian, L. ferrea merupakan tanaman obat yang bermanfaat dan tersedia untuk penggunaan rasional guna menghasilkan fitoterapi.
Penelitian fitokimia sebelumnya telah melaporkan adanya metabolit sekunder bioaktif seperti asam galat, asam ellagik, katekin, epikatekin, quercetin, dan Pauferrol A di berbagai bagian L. ferrea , yang dikenal karena potensinya untuk mengobati/menghambat penyakit Alzheimer (AD) [ 3 , 7 ].
AD merupakan penyakit neurodegeneratif yang menyerang ribuan orang di seluruh dunia. Asetilkolinesterase (AChE) merupakan enzim penting dalam hidrolisis salah satu neurotransmitter yang paling dikenal, asetilkolin (ACh), yang telah dikaitkan dengan patofisiologi AD. Oleh karena itu, penghambatan AChE telah menjadi strategi pengobatan yang banyak digunakan untuk AD. Beberapa produk alami telah diteliti di seluruh dunia dengan tujuan menemukan agen antikolinesterase baru yang dapat digunakan sebagai pilihan terapi dalam pengobatan AD [ 8 , 9 ].
Radikal bebas adalah produk sampingan metabolisme yang diperlukan untuk fungsi fisiologis tetapi dapat bersifat toksik pada kadar tinggi. Radikal bebas ini meningkat secara bertahap sepanjang hidup, mengganggu fungsi mitokondria dan merusak seluruh bagian tubuh, terutama sistem saraf pusat. Beberapa bukti menunjukkan bahwa stres oksidatif mungkin merupakan salah satu mekanisme utama yang menyebabkan penuaan kognitif dan penyakit neurodegeneratif seperti AD. Cara yang paling umum untuk mengurangi stres oksidatif adalah pengobatan antioksidan [ 10 ].
Bukti yang berkembang menunjukkan bahwa peradangan dapat menjadi kontributor utama terhadap perkembangan dan eksaserbasi AD. Sitokin pro-inflamasi seperti tumor necrosis factor- α , interleukin (IL)-1β, dan IL-6 meningkat di otak individu dengan AD, yang menyebabkan akumulasi agregat plak Aβ dan hiperfosforilasi tau yang mengakibatkan hilangnya neuron. Peradangan dan AD tidak dapat dihindari, dengan penelitian lebih lanjut diperlukan untuk memperkuat mekanisme yang terkait dengannya, termasuk asupan antioksidan untuk hidup yang lebih sehat [ 11 ].
Aktivitas antiinflamasi dan antioksidan L. ferrea sebelumnya telah mendorong penelitian ini untuk mengevaluasi beberapa ekstrak etanol dan minyak atsiri dari bagian tanaman, komposisinya, dan aktivitas penghambatan AChE, untuk menyelidiki potensi neurofarmakologis L. ferrea , terutama mengingat minat yang semakin meningkat pada produk alami dengan aksi pada sistem kolinergik, yang terkait dengan pencegahan dan/atau pengobatan penyakit neurodegeneratif, seperti Alzheimer. Kemudian, tujuan penelitian ini adalah untuk mengkarakterisasi senyawa kimia dalam ekstrak L. ferrea dengan aksi antioksidan dan antikolinesterase, yang dapat berguna untuk pengobatan AD.
2 Hasil dan Pembahasan
Dalam uji prospek fitokimia, semua ekstrak yang dievaluasi (ELLF, EBLF, dan MFLF) menunjukkan warna kebiruan disertai pembentukan endapan, yang menunjukkan adanya tanin yang dapat dihidrolisis.
Dalam analisis spektrum ultraviolet (UV) ekstrak (Gambar 1 ), puncak serapan diidentifikasi pada panjang gelombang antara 260 dan 280 nm, rentang khas yang terkait dengan tanin yang dapat dihidrolisis, yang menunjukkan bahwa senyawa ini sebagian besar hadir. Penyerapan dalam rentang ini dikaitkan dengan transisi elektronik π→π*, yang terjadi pada cincin aromatik yang merupakan karakteristik struktur tanin [ 12 ].
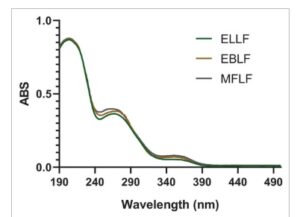
GAMBAR 1
Buka di penampil gambar
Presentasi PowerPoint
Spektrum ultraviolet (UV) untuk ekstrak kaya tanin.
Tanin yang dapat dihidrolisis adalah senyawa fenolik yang banyak ditemukan pada tanaman dan memiliki pita karakteristik dalam spektroskopi inframerah transformasi Fourier (FTIR), karena adanya gugus fungsi tertentu (Gambar 2 ). Di antara serapan utama dalam ekstrak, pita terluas dan paling intens menonjol di wilayah 3156–3574 cm⁻¹, yang sesuai dengan peregangan ikatan O─H, yang terdapat dalam hidroksil cincin fenolik dan dalam struktur glukosa. Selain itu, wilayah antara 2800–3000 cm⁻¹ menunjukkan pita karakteristik peregangan C─H, yang terkait dengan ikatan sp 2 dari cincin aromatik dan ikatan sp 3 dari struktur glukosa. Keberadaan gugus ester dan asam karboksilat dapat dikonfirmasi oleh penyerapan intens mendekati 1700 cm⁻¹, yang dikaitkan dengan peregangan C ═ O, yang menunjukkan pembentukan ester antara asam fenolik (seperti asam galat dan asam ellagik) dan glukosa. Cincin aromatik tanin yang dapat dihidrolisis juga menghasilkan pita signifikan antara 1500 dan 1600 cm⁻¹, yang terkait dengan peregangan ikatan C ═ C, yang menunjukkan sifat polifenol dari senyawa ini. Selain itu, gugus ester dan alkohol fenolik menunjukkan pita dalam kisaran 1200–1300 cm⁻¹, yang disebabkan oleh peregangan C─O, sedangkan gugus C─OH dari hidroksil aromatik menyerap pada 1000–1100 cm⁻¹. Dengan demikian, analisis spektroskopi memungkinkan karakterisasi tanin terhidrolisis yang lebih baik dalam ekstrak tumbuhan, berkontribusi pada pemahaman sifat kimia dan biologinya [ 13 ].

GAMBAR 2
Buka di penampil gambar
Presentasi PowerPoint
Spektroskopi inframerah transformasi Fourier (FTIR) untuk: (A) Ekstrak hidroetanol dari daun L. ferrea (ELLF); (B) Ekstrak hidroetanol dari kulit kayu L. ferrea (EBLF); (C) Fraksi metanol dari biji L. ferrea (MFLF).
Senyawa fenolik terkenal karena sifat antioksidannya yang kuat, yang memungkinkannya menetralkan radikal bebas dan melindungi sel dari kerusakan oksidatif [ 14 ]. Dalam penelitian ini, total kandungan fenolik sangat tinggi baik di ELLF maupun MFLF, dengan nilai masing-masing 554,94 ± 1,24 dan 506,82 ± 1,14 GAE/g. Di antara ini, tanin sangat melimpah di MFLF, meliputi hampir 95% dari total senyawa fenolik (Tabel 1 ). Kehadiran yang signifikan ini menunjukkan pentingnya tanin sebagai kontributor utama terhadap aktivitas antioksidan yang diamati.
TABEL 1. Evaluasi total fenol, flavonoid, dan tanin ekstrak L. ferrea .
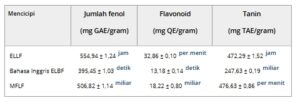
ELLF—Ekstrak hidroetanol dari daun L. ferrea ; EBLF—Ekstrak hidroetanol dari kulit kayu L. ferrea ; MFLF—Fraksi metanol dari biji L. ferrea ; GAE—Ekuivalen fenol dalam miligram asam galat per gram ekstrak; QE—Ekuivalen flavonoid dalam miligram quercetin per gram ekstrak; TAE—Ekuivalen asam tanat dalam miligram ekstrak; Huruf kecil yang berbeda menunjukkan perbedaan yang signifikan secara statistik ( p < 0,05, ANOVA diikuti oleh uji Tukey).
a,b,c Mengacu pada perbandingan statistik dalam kelompok.
Selain itu, tanin banyak didokumentasikan dalam literatur tidak hanya karena sifat antioksidannya [ 15 ] tetapi juga karena efek neuroprotektifnya [ 16 ]. Sifat bioaktif ini menyoroti potensinya sebagai agen terapeutik dalam pencegahan dan pengobatan gangguan yang berhubungan dengan stres oksidatif, termasuk penyakit neurodegeneratif seperti Alzheimer.
Semua sampel menunjukkan aktivitas antioksidan yang kuat, dengan MFLF menunjukkan penghambatan radikal 2,2-difenil-1-pikrilhidrazil (DPPH) yang mengesankan (IC 50 2,39 ± 0,10 µg/mL), secara statistik sebanding dengan standar asam galat dan bahkan lebih kuat daripada antioksidan komersial Trolox (Tabel 2 ). Aktivitas kuat ini kemungkinan besar disebabkan oleh kandungan fenolik tinggi yang diamati pada Tabel 1 . Nilai IC 50 , semuanya di bawah 50 µg/mL, semakin menegaskan potensi antioksidan yang kuat dari ekstrak ini [ 17 ]. Khususnya, tanin, yang merupakan hampir 95% dari total kandungan fenolik dalam MFLF, diakui sebagai kontributor utama aktivitas ini. Kemampuan mereka untuk menyumbangkan elektron dan menstabilkan radikal bebas menunjukkan peran mereka sebagai pendorong utama efek antioksidan yang diamati [ 18 ]. Bahasa Indonesia: Jika dibandingkan dengan ekstrak tumbuhan lain dari famili Fabaceae, Dalbergia nitidula menunjukkan nilai IC₅₀ sebesar 9,31 ± 2,14 µg/mL untuk penangkal radikal DPPH, yang menunjukkan aktivitas antioksidan yang serupa dengan yang diamati untuk ekstrak ELLF. Sebaliknya, spesies seperti Virgilia divaricata , Erythrina caffra , dan Baphia racemosa menunjukkan nilai IC₅₀ lebih besar dari 100 µg/mL [ 19 ] dan oleh karena itu diklasifikasikan sebagai memiliki aktivitas antioksidan rendah [ 17 ]. Temuan ini menunjukkan bahwa tidak semua spesies dalam famili Fabaceae memiliki potensi antioksidan yang tinggi, yang menyoroti pentingnya melakukan penilaian individual dalam kelompok tersebut.
TABEL 2. Aktivitas antioksidan dan anti-asetilkolinesterase ekstrak L. ferrea .
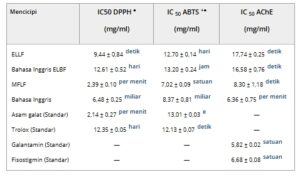
ELLF—Ekstrak hidroetanol dari daun L. ferrea ; EBLF—Ekstrak hidroetanol dari kulit kayu L. ferrea ; MFLF—Fraksi metanol dari biji L. ferrea ; EOLF—Minyak atsiri dari bunga L. ferrea ; IC 50 – Konsentrasi penghambatan sebesar 50%; Huruf kecil yang berbeda menunjukkan perbedaan yang signifikan secara statistik ( p < 0,05, ANOVA diikuti dengan uji Tukey).
a,b,c,d,e Mengacu pada perbandingan statistik dalam grup.
Beberapa senyawa antioksidan memiliki struktur kimia yang mampu berinteraksi dengan situs katalitik atau anionik enzim AChE, menghambat aktivitasnya melalui interaksi hidrofobik, ikatan hidrogen, atau gaya Van der Waals. Selain itu, stres oksidatif dikaitkan dengan disfungsi kolinergik dan peningkatan aktivitas AChE. Dengan demikian, senyawa dengan aksi antioksidan dapat melemahkan kerusakan oksidatif dengan menetralkan spesies oksigen reaktif (ROS), memodulasi sistem kolinergik secara positif dan, akibatnya, mengurangi ekspresi berlebihan atau hiperaktivitas enzim ini [ 20 ]. Hubungan ini tampaknya ada dalam ekstrak jucá, yang menunjukkan kapasitas penghambatan AChE yang tinggi, dengan nilai IC₅₀ di bawah 20 µg/mL [ 21 ]. Di antara sampel yang dievaluasi, EOLF dan MFLF menonjol dengan nilai IC₅₀ masing-masing sebesar 6,36 ± 0,75 dan 8,30 ± 1,18 µg/mL. Khususnya, kinerja EOLF patut dicatat karena menyajikan potensi penghambatan yang secara statistik sebanding dengan penghambat referensi klasik, galantamine (5,82 ± 0,02 µg/mL) dan physostigmine (6,68 ± 0,08 µg/mL) (Tabel 2 ), keduanya banyak digunakan sebagai model terapi dalam pengobatan AD. Hasil-hasil ini menunjukkan bahwa ekstrak daun minyak atsiri (EOLF) merupakan sumber alami senyawa bioaktif yang menjanjikan dengan potensi aplikasi dalam pengembangan penghambat AChE, memperkuat relevansi farmakologis spesies yang diselidiki.
Dalam konteks yang lebih luas, saat menilai aktivitas penghambatan AChE dari spesies Fabaceae yang sebelumnya dilaporkan menunjukkan potensi antioksidan yang kuat (IC₅₀ < 50 µg/mL), Cenostigma pyramidale (IC₅₀ = 7,04 ± 0,04 µg/mL) dan Caesalpinia pulcherrima (IC₅₀ = 13,14 ± 0,01 µg/mL) telah menunjukkan penghambatan enzim yang sangat tinggi. Sebaliknya, Bauhinia forficata (IC₅₀ = 29,2 ± 1,87 µg/mL) dan Hymenaea stigonocarpa (IC₅₀ = 23,98 ± 0,11 µg/mL) hanya menunjukkan aktivitas penghambatan sedang (20 < IC₅₀ < 50 µg/mL) [ 17 , 22 ]. Temuan ini menekankan variabilitas yang cukup besar dalam kapasitas penghambatan AChE di antara spesies Fabaceae, bahkan di antara spesies dengan sifat antioksidan yang menonjol, yang menggarisbawahi pentingnya melakukan evaluasi bioaktivitas komplementer untuk penyaringan farmakologis.
2.1 Analisis Kromatografi dengan Kromatografi Cair Kinerja Tinggi dan Kromatografi Gas/Spektrometri Massa
Karakterisasi dan kuantifikasi senyawa, yang dilakukan dengan kromatografi cair kinerja tinggi-deteksi array dioda (HPLC-DAD), mengungkapkan keberadaan asam galat, asam klorogenat, katekin, asam kafeat, rutin, dan asam ellagic di hampir semua bagian tanaman (Tabel 3 ). EBLF adalah satu-satunya ekstrak yang menunjukkan keberadaan quercetin, dengan 7,26 ± 0,60 mg/g. ELLF memiliki konsentrasi asam ellagic tertinggi, dengan 26,28 ± 0,47 mg/g ekstrak. Tanin yang dapat dihidrolisis adalah senyawa fenolik yang disintesis oleh tanaman melalui jalur shikimat dan fenilpropanoid, dengan β-glukogalin sebagai prekursor sentral.
TABEL 3. Kuantifikasi senyawa fenolik dalam daun, kulit kayu, dan biji L. ferrea menggunakan kromatografi cair kinerja tinggi (HPLC) .
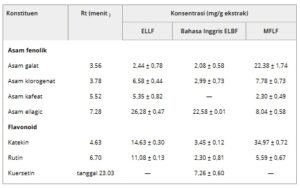
R t —Waktu retensi; ELLF—Ekstrak hidroetanol dari daun L. ferrea ; EBLF—Ekstrak hidroetanol dari kulit kayu L. ferrea ; MFLF—Fraksi metanol dari biji L. ferrea .
Kehadiran asam galat dan asam ellagik yang diidentifikasi dalam ekstrak mengkonfirmasi keberadaan tanin terhidrolisis karena ini disintesis dari asam galat, melalui jalur shikimat [ 23 – 25 ]. Senyawa-senyawa ini juga dikenal karena aktivitas antivirus, antiparasit, antiinflamasi, antidiare, dan antioksidannya [ 26 ].
MFLF dan EOLF merupakan ekstrak yang lebih menjanjikan sebagai antioksidan dan penghambat antikolinesterase, kemudian tanin terhidrolisis dari fraksi metanol biji merupakan ekstrak yang paling menjanjikan untuk pengobatan Alzheimer, walaupun ELLF dan EBLF juga harus dipertimbangkan karena keduanya lebih mudah diperoleh sepanjang tahun.
Ekstraksi minyak atsiri dari L. ferrea memiliki rendemen sebesar 0,02%. Analisis kromatografi gas/spektrometri massa (GC/MS) dari minyak ini (Tabel 4 ) mengungkapkan bahwa (Z)-9-tetradecenyl asetat diidentifikasi sebagai senyawa utama (59,70%). Zat ini dikenal karena aromanya yang khas, sering digambarkan sebagai bau bunga, manis, dan buah. Pada beberapa serangga, misalnya, zat ini dapat bertindak sebagai feromon agregasi, menarik individu dari spesies yang sama untuk berkumpul di tempat tertentu [ 27 ]. Khususnya, identifikasi konstituen dalam minyak atsiri L. ferrea belum pernah terjadi sebelumnya dan, sejauh pengetahuan kami, belum pernah dilaporkan sebelumnya dalam literatur.
TABEL 4. Analisis kromatografi gas/spektrometri massa (GC/MS) minyak atsiri dari bunga L.
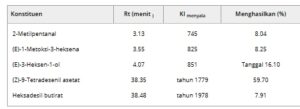
KI—Indeks literatur Kovats; R t —Waktu retensi.
Konstituen kedua adalah (E)-3-Hexen-1-ol (16,10%), senyawa organik yang diproduksi oleh tanaman yang mengusir serangga. Kehadiran senyawa volatil atau minyak esensial dalam tanaman memberikan strategi pertahanan tanaman yang penting, terutama terhadap hama serangga herbivora. Senyawa volatil ini juga memainkan peran penting dalam interaksi tanaman-tanaman dan berfungsi sebagai atraktan bagi beberapa serangga penyerbuk [ 28 ]. (E)-3-Hexen-1-ol, disebut alkohol daun, terutama digunakan dalam industri parfum sebagai pewangi, dalam industri makanan sebagai perasa buah dan sayuran, serta dalam aromaterapi, dan dalam pengobatan. Ini digunakan dalam berbagai macam produk karena bau rumput hijau segar yang kuat dan khas. (E)-3-Hexen-1-ol juga diidentifikasi sebagai feromon untuk beberapa serangga, dan memiliki karakteristik menarik berbagai serangga predator [ 29 ]. Minyak atsiri dari L. ferrea meski menunjukkan aksi yang baik sebagai antioksidan dan penghambat antikolinesterase, diproduksi dalam persentase yang sangat rendah, meskipun demikian senyawanya menunjukkan kemiripan dengan galantamine dan physostigmine dalam cara kerja dan energi interaksi, yang mewakili pola untuk sintesis organik, yang ditujukan untuk aplikasi yang lebih spesifik untuk pengobatan DA.
Kehadiran hanya lima senyawa dalam minyak atsiri bunga L. ferrea (Tabel 4 ), salah satunya mencakup sekitar 59,70% dari total komposisi, menunjukkan profil kimia yang ditandai dengan dominasi konstituen utama. Pola ini sering diamati dalam minyak atsiri yang diperoleh dari bunga, yang cenderung menyajikan senyawa volatil spesifik dengan fungsi ekologis, seperti menarik penyerbuk. Dominasi metabolit tunggal dapat dikaitkan dengan keberadaan kemotipe, variasi genetik dalam spesies yang memprioritaskan biosintesis senyawa tertentu, selain dipengaruhi oleh faktor musiman dan lingkungan, seperti cahaya dan suhu pada saat pengumpulan [ 30 – 32 ]. Selain itu, teknik ekstraksi hidrodistilasi dapat mendukung pemulihan senyawa yang lebih mudah menguap dan termostabil, menghasilkan profil dengan keragaman kimia rendah yang dapat dideteksi oleh GC-MS [ 33 , 34 ]. Penting untuk digarisbawahi bahwa tidak adanya keragaman senyawa yang terdeteksi tidak membatalkan aktivitas biologis minyak, karena mayoritas konstituen mungkin bertanggung jawab utama atas sifat farmakologis yang relevan.
2.2 Docking Molekuler Konstituen Minyak Atsiri dalam AChE
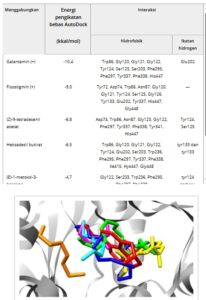
Untuk memvalidasi protokol docking molekuler, struktur kristalografi galantamin yang terikat pada AChE manusia (PDB ID: 4EY6) di-dock ulang, menghasilkan deviasi kuadrat rata-rata (RMSD) sebesar 0,632. Nilai RMSD yang rendah ini menegaskan akurasi dan keandalan prosedur docking yang tinggi [ 35 ]. Energi bebas pengikatan yang dihitung ulang untuk galantamin adalah -10,4 kkal/mol, yang berfungsi sebagai titik referensi yang kuat untuk mengevaluasi afinitas pengikatan ligan lainnya.
Seperti yang disajikan dalam Tabel 5 , energi bebas pengikatan galantamine, physostigmine, hexadecyl butirat, (Z)-9-tetradecenyl asetat, (E)-1-metoksi-3-heksena, 2-metilpentanal, dan (E)-3-heksen-1-ol dihitung menggunakan AutoDock Vina. Baik galantamine dan physostigmine menunjukkan afinitas pengikatan yang kuat dan terlibat dalam interaksi dengan residu situs aktif utama, khususnya Gly120, Tyr124, Ser125, dan Glu202. Residu ini tampaknya memainkan peran sentral dalam stabilisasi ligan dan, sebagai perluasan, dalam penghambatan AChE. Distribusi spasial senyawa-senyawa ini dalam situs aktif AChE diilustrasikan dalam Gambar 3 , di mana orientasi pengikatan dan tumpang tindihnya dapat divisualisasikan secara langsung.
TABEL 5. Nilai energi bebas pengikatan dihitung melalui docking molekuler dan residu asam amino di situs aktif yang berinteraksi dengan ligan hingga jarak 4 Å.
GAMBAR 3
Buka di penampil gambar
Presentasi PowerPoint
Hasil docking molekular menunjukkan posisi galantamine dalam warna merah, physostigmine dalam warna kuning, hexadecyl butirat dalam warna biru, (Z)-9-tetradecenyl asetat dalam warna hijau, (E)-1-metoksi-3-heksena dalam warna cyan, 2-metilpentanal dalam warna magenta, dan (E)-3-heksen-1-ol dalam warna oranye.
Di antara senyawa alami yang dievaluasi, heksadesil butirat dan (Z)-9-tetradesil asetat menonjol, dengan energi bebas pengikatan masing-masing sebesar -6,8 dan -6,5 kkal/mol. Meskipun afinitasnya lebih rendah dibandingkan dengan inhibitor referensi, kedua senyawa berinteraksi dengan residu situs aktif yang penting. Secara khusus, heksadesil butirat membentuk interaksi hidrofobik dengan Trp86, Gly120, Tyr124, dan ikatan hidrogen dengan Tyr133, sementara (Z)-9-tetradesil asetat membentuk interaksi hidrofobik dengan Asp74, Trp86, Phe297, dan ikatan hidrogen dengan Tyr124 dan Ser125.
Relevansi biologis dari interaksi ini khususnya penting untuk (Z)-9-tetradecenyl asetat, konstituen utama (59,70%) minyak esensial dari bunga L. ferrea . Meskipun skor docking-nya sederhana jika dibandingkan dengan galantamine, IC₅₀ in vitro-nya secara statistik setara dengan obat komersial (Tabel 2 ). Ini mendukung hipotesis bahwa mode pengikatan (Z)-9-tetradecenyl asetat, yang sangat mirip dengan galantamine dalam hal keterlibatan residu utama, dapat mendukung penghambatan AChE yang efektif [ 36 ].
Sebaliknya, senyawa alami lainnya seperti (E)-1-metoksi-3-heksena, 2-metilpentanal, dan (E)-3-heksen-1-ol menunjukkan energi pengikatan yang lebih lemah dan interaksi yang terbatas dengan situs aktif AChE. Ligand ini membentuk lebih sedikit ikatan hidrofobik dan hidrogen serta tidak memiliki ikatan dengan residu penting yang diidentifikasi di atas, yang menunjukkan potensi penghambatan yang jauh lebih rendah.
Temuan ini menggarisbawahi potensi farmakologis (Z)-9-tetradecenyl asetat dan heksadesil butirat sebagai penghambat AChE alami yang menjanjikan. Interaksinya dengan residu katalitik utama dan profil docking yang menguntungkan membenarkan penyelidikan lebih lanjut, terutama dengan mempertimbangkan relevansi biologis yang ditunjukkan dalam uji in vitro untuk (Z)-9-tetradecenyl asetat.
3 Kesimpulan
Studi saat ini mengkarakterisasi senyawa fenolik dalam ekstrak melalui analisis HPLC dari berbagai bagian L. ferrea , yang sebagian besar terdiri dari tanin yang dapat dihidrolisis. Kedua ekstrak memiliki aktivitas penghambatan yang tinggi terhadap radikal DPPH (IC50 < 50 µg/mL) dan enzim AChE (IC50 < 20 µg/mL). Analisis in silico mengungkapkan bahwa senyawa utama minyak atsiri yang diidentifikasi dalam GC, (Z)-9-tetradecenyl asetat, mengikat ke situs aktif yang sama dengan galantamine, yang selanjutnya mendukung potensi neuroprotektifnya, terutama dalam konteks penyakit neurodegeneratif seperti AD.
Secara keseluruhan, temuan ini menunjukkan potensi manfaat terapeutik dari berbagai bagian L. ferrea dalam mengobati AD melalui mekanisme antioksidan dan peningkatan kognitif. Namun, penelitian lebih lanjut diperlukan untuk memvalidasi efek ini dan menilai penerapan klinisnya.
4 Eksperimental
4.1 Memperoleh Materi
Daun tanaman L. ferrea dikumpulkan pada bulan Maret 2023, di Universitas Negeri Ceará. Salinan spesimen ini ada di Herbarium Prisco Bezerra (EAC) Universitas Federal Ceará (UFC), dengan identifikasi botani L. ferrea (Mart. Ex Tul.). LP Queiroz disimpan dengan nomor 66363 dan diidentifikasi oleh ahli botani Hugo Pereira yang lahir pada bulan Maret 2023. SisGen n° AFB0E62.
4.2 Ekstrak Daun, Kulit Kayu, dan Biji L. ferrea
Daun dan kulit L. ferrea dikumpulkan (200 g), dikeringkan dalam oven pada suhu 80°C, digiling, dan dilakukan metode maserasi dengan etanol 70% dalam rasio etanol-material 1:1 pada suhu ruangan (25°C), selama 7 hari berturut-turut, tanpa penambahan cairan ekstraksi. Cairan ekstraksi kemudian disaring dan dipekatkan dalam rotary evaporator pada suhu 50°C. Larutan tersebut dilakukan liofilisasi, menghasilkan ELLF dengan rendemen 10,48% dan EBLF dengan rendemen 12,31%.
Benih L. ferrea dikumpulkan (200 g), dikeringkan, digiling, dan dimasukkan ke dalam metode ekstraksi Soxhlet selama 8 jam dengan heksana PA dan kemudian selama 8 jam dengan metanol PA. Cairan ekstraksi kemudian disaring dan dipekatkan dalam evaporator putar pada suhu 50°C. Larutan polar yang diinginkan mengalami liofilisasi, menghasilkan MFLF dengan hasil 9,5%.
4.3 Memperoleh Minyak Atsiri dari Bunga L. ferrea
Bunga L. ferrea dikumpulkan (500 g) dan diekstraksi dengan hidrodistilasi dalam peralatan tipe Clevenger. Untuk tujuan ini, bunga segar ditambahkan ke labu alas bulat 1 L, bersama dengan air suling sampai bunga tertutup seluruhnya di dalam labu. Prosedur berlangsung sekitar 4 jam setelah dimulainya kondensasi uap. Prosedur berlangsung sekitar 4 jam setelah dimulainya kondensasi uap. Minyak dikeluarkan dari peralatan Clevenger dan disaring dengan natrium sulfat anhidrat (untuk menghilangkan air).
4.4 Analisis Tanin dalam Ekstrak Tumbuhan
Untuk mengidentifikasi jenis tanin yang ada dalam ekstrak tanaman, prospeksi fitokimia kualitatif awalnya dilakukan dengan menggunakan reagen besi klorida (FeCl₃) [ 37 ]. Ekstrak kemudian dikenakan analisis spektrofotometri UV-visibel dalam mode pemindaian (200–800 nm), yang memungkinkan spektrum karakteristik senyawa yang ada diperoleh [ 38 ].
4.5 Kuantifikasi Total Fenol, Flavonoid dan Tanin
Penentuan kadar total fenol dilakukan dengan menggunakan spektroskopi daerah tampak dengan reagen Folin-Ciocalteu, mengikuti metodologi Sousa et al. [ 39 ] Untuk kuantifikasi flavonoid, digunakan reagen aluminium klorida (AlCl 3 ) 2,5%, mengikuti metodologi Funari dan Ferro [ 40 ]. Penentuan kadar total tanin dilakukan dengan menggunakan spektroskopi daerah tampak dengan reagen Folin-Denis [ 41 ].
4.6 Evaluasi Aktivitas Antioksidan dengan Metode Penghambatan Radikal Bebas DPPH dan ABTS
Aktivitas antioksidan dievaluasi menggunakan metode DPPH mengikuti metodologi yang dijelaskan oleh Becker et al. [ 42 ] dengan modifikasi, dan metode 2,2′-azino-bis (asam 3-etilbenzotiazolin-6-sulfonat) seperti yang dijelaskan oleh Rhee et al. [ 43 ] Kedua pengujian dilakukan dalam mikroplat dasar datar 96 sumur menggunakan pembaca BioTek Elisa, model ELX 800.
4.7 Evaluasi In Vitro Penghambatan AChE
Aktivitas penghambatan enzim rekombinan AChE diukur dalam pelat dasar datar 96-sumur menggunakan pembaca ELISA BioTek, model ELX 800, dengan perangkat lunak “Gen5 V2.04.11”, berdasarkan metodologi yang dijelaskan oleh Re et al. [ 44 ] dan Trevisan et al. [ 45 ] Semua larutan digunakan sebagai standar negatif, kecuali sampel. Semua sampel dianalisis dalam rangkap tiga.
4.8 Spektroskopi IR Transformasi Fourier
Penentuan gugus fungsi dilakukan dengan spektroskopi inframerah, menggunakan spektrofotometer FTIR FTIR Agilent FTIR (model Cary 660) dari 4000 hingga 400 cm −1 dengan resolusi 4,0 cm −1 dan 25 pemindaian.
4.9 HPLC dengan DAD
Untuk mengidentifikasi senyawa fenolik, larutan metanol dari setiap sampel (20 µL/mL) disuntikkan ke dalam sistem HPLC. Standar diperoleh dari Sigma, dan pelarut kelas analitis digunakan untuk ekstraksi, sementara pelarut kelas HPLC digunakan dalam analisis. Sampel dan larutan disaring melalui membran nilon (0,45 dan 0,22 µm) sebelum analisis, yang dilakukan sebanyak tiga kali. Analisis HPLC-DAD dilakukan menggunakan sistem Shimadzu dengan kolom fase terbalik Shim-pack ODS GOLD. Fase mobilnya adalah asetonitril dan air Milli-Q yang diasamkan hingga pH 2,8, menggunakan gradien: 0–15 menit (20:80 v/v), 17–25 menit (40:60 v/v), dan 25–40 menit (20:80 v/v). Laju alirnya adalah 1,0 mL/menit, dengan volume injeksi 20 µL dan deteksi pada 350 nm. Puncak dikonfirmasi oleh waktu retensi dan spektrum DAD (200–400 nm).
4.10 Analisis CG/MS Minyak Atsiri L. ferrea
Minyak atsiri bunga L. ferrea dianalisis menggunakan peralatan Shimadzu QP-2010 dengan kolom kapiler Rxt-5MS (30 m × 0,25 mm × 0,25 µm), menggunakan helium sebagai gas pembawa pada laju alir 24,2 mL/menit. Suhu injektor dan detektor diatur ke 250°C dan program suhu dimulai pada 35°C, ditingkatkan pada 4°C/menit hingga 180°C, kemudian pada 17°C/menit hingga 280°C, bertahan selama 10 menit terakhir. Spektrum massa diperoleh dengan tumbukan elektron (70 eV) dan dibandingkan dengan pustaka NIST untuk saran senyawa. Identifikasi dikonfirmasi dengan membandingkan spektrum massa dan indeks Kovats dengan basis data NIST dan Adams [ 46 ]. Nilai Indeks Kovat eksperimen dihitung melalui regresi linier waktu retensi.
4.11 Studi In Silico
Reseptor AChE manusia rekombinan (PDB: 4EY6) yang dikomplekskan dengan galantamine diperoleh dari RSCB Protein Data Bank, dengan resolusi 2,40 Å [ 47 ]. Molekul air dan senyawa lain dihilangkan, dan atom hidrogen polar dan muatan atom Kollman ditambahkan. Struktur kimia galantamine diekstraksi dari data PDB yang sesuai, sementara struktur 2D ligan lain digambar menggunakan ChemSketch, dan struktur 3D-nya disiapkan dengan 3D Viewer. Untuk mengonfirmasi akurasi docking, ligan asli (galantamine) dihilangkan, dan docking ulang dilakukan dengan RMSD < 2 Å yang dianggap berhasil. RMSD antara struktur kristalografi dan struktur yang di-docking dihitung menggunakan alat DockRMSD [ 48 ]. Perhitungan mempertimbangkan pembentukan ikatan hidrogen, interaksi van der Waals yang menarik, interaksi elektrostatik, dan interaksi hidrofobik yang menarik [ 49 ]. Docking molekular kemudian dilakukan menggunakan perangkat lunak AutoDock 4.2 untuk memprediksi orientasi ligan dan menghitung energi bebas pengikatan [ 50 ]. Reseptor dijaga tetap kaku, sedangkan ligan fleksibel, dengan algoritma genetik Lamarckian sebagai parameter pencarian. Setiap ligan didocking dalam 50 konformasi dalam kotak grid 60 × 60 × 60 Å. Hasilnya dianalisis dengan AutoDock Tools dan divisualisasikan dengan Chimera [ 51 ]. Pose docking yang paling menguntungkan secara energetik dipilih, dan interaksi divalidasi menggunakan Ligplot+ untuk menghasilkan diagram 2D ikatan hidrogen dan interaksi hidrofobik [ 52 ].

