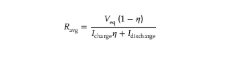Abstrak
Baterai natrium–seng klorida (Na-ZnCl₂) menawarkan alternatif berkelanjutan untuk baterai natrium–nikel klorida (Na-NiCl₂) tetapi menghadapi tantangan dengan energi spesifik dan siklus hidup yang rendah. Studi ini mengevaluasi dua desain elektroda: butiran Zn/NaCl berbasis partikel konvensional dan elektroda Zn/NaCl berbasis busa yang baru dikembangkan. Elektroda berbasis partikel, dengan pemanfaatan Zn 30%, didaur ulang dalam sel tubular dengan beban massa 1,13 g cm −2 dan kapasitas areal 150 mAh cm −2 , mencapai energi spesifik 231 Wh kg⁻¹ pada tingkat komposit elektroda pada 15 mA cm⁻ 2 tetapi mengalami penurunan efisiensi tegangan karena aglomerasi Zn. Untuk mengatasi hal ini, elektroda Zn/NaCl berbasis busa dikembangkan, meningkatkan pemanfaatan Zn hingga 66%. Didaur ulang dalam sel Na-ZnCl₂ planar, elektroda berbasis busa ini mencapai lebih dari 200 mAh cm −2 kapasitas areal pada beban massa 1,04 g cm −2 , menyediakan energi spesifik sebesar 336 Wh kg⁻¹ pada 15 mA cm⁻ 2 dengan profil tegangan yang stabil. Desain berbasis busa menstabilkan mikrostruktur elektroda, menghasilkan kapasitas pelepasan kumulatif yang tinggi sebesar 5,4 Ah cm⁻ 2 dengan efisiensi tegangan yang stabil. Hasil ini menunjukkan beban massa dan kapasitas areal tertinggi yang dilaporkan untuk sel natrium logam klorida hingga saat ini, yang menunjukkan potensinya untuk memungkinkan baterai Na-ZnCl₂ yang hemat biaya untuk aplikasi penyimpanan energi stasioner.
1 Pendahuluan
Meningkatnya permintaan energi global telah meningkatkan fokus pada sumber energi terbarukan seperti tenaga surya dan angin. Memajukan solusi penyimpanan energi stasioner sangat penting untuk memaksimalkan efisiensi sistem ini. Baterai natrium-nikel klorida (Na-NiCl 2 ) dianggap sebagai kandidat yang menjanjikan untuk aplikasi penyimpanan energi stasioner skala besar karena memberikan stabilitas siklus yang sangat baik, standar keamanan yang tinggi karena tidak adanya thermal runaway, persyaratan perawatan yang rendah, dan penggunaan material yang melimpah di bumi. [ 1 ] Namun, Ni telah mengalami fluktuasi harga yang signifikan dalam beberapa tahun terakhir karena dinamika rantai pasokan, pergeseran permintaan, dan peristiwa geopolitik. [ 2 ] Selain itu, penambangan Ni merupakan pendorong utama penggundulan hutan yang menciptakan dilema sehubungan dengan tujuan iklim yang menyeluruh. [ 3 ] Masalah-masalah ini tidak khusus untuk Na-NiCl 2, tetapi juga sangat memengaruhi industri baterai lithium-ion. Metode yang efektif untuk membuat baterai Na-NiCl 2 lebih hemat biaya dan lebih berkelanjutan adalah dengan mengganti Ni dengan seng (Zn). [ 4 ] Zn memiliki kelimpahan yang sama dengan Ni di kerak bumi (75 ppm vs 80 ppm), [ 5 ] tetapi jauh lebih mudah, lebih murah, dan lebih hemat energi untuk diekstraksi (10–15 MJ kg −1 vs 30–50 MJ kg −1 ). [ 6 ] Selain itu, Zn menyebabkan kurang dari setengah deforestasi global yang disebabkan oleh Ni, meskipun produksi Zn tahunan saat ini lebih dari empat kali lebih besar daripada Ni (3 Mt vs 14 Mt). [ 7 ] Meskipun memiliki keunggulan ekonomi dan ekologi ini, baterai natrium–seng klorida (Na-ZnCl 2 ), yang menggunakan material elektroaktif berbasis Zn di elektroda positif, menghadapi beberapa tantangan teknologi mendasar yang perlu ditangani sebelum digunakan secara komersial. Satu tantangan utama adalah bahwa sel Na-ZnCl2 menyediakan tegangan kesetimbangan rata-rata yang lebih rendah sebesar ≈2,0 V versus Na + /Na, [ 4 ] dibandingkan dengan 2,5 V dalam sel Na-NiCl2 , [ 8 ] yang mengakibatkan energi spesifik yang secara inheren lebih rendah sehubungan dengan kandungan bahan aktif. Selain itu, sel Na-ZnCl₂ dengan elektroda positif Zn/NaCl berbasis partikel rentan terhadap penurunan kinerja karena pengasaran atau penggumpalan Zn, yang muncul karena reaksi konversi dalam sel Na-ZnCl2 melibatkan pembentukan fase aktif elektrokimia cair selama siklus pada suhu di atas 240 °C.[ 4 ] Namun, keberadaan fase aktif cair dapat diubah menjadi suatu keuntungan jika dapat memungkinkan desain elektroda baru dengan peningkatan pemanfaatan logam aktif. Untuk menjelaskan konsep ini, penting untuk memahami alasan di balik struktur elektroda yang diterapkan dalam sel Na-NiCl₂ komersial, dan kesulitan yang terkait dengan peningkatan pemanfaatan logam aktif dalam elektroda Na-NiCl₂ dan Na-ZnCl₂ berbasis partikel.
Dalam sel Na-NiCl 2 komersial mutakhir , bahan elektroda positif Ni/NaCl berbasis partikel, dilengkapi dengan Fe/NaCl, digranulasi. [ 1 ] Granulasi ini memungkinkan pengisian otomatis ke dalam sel tubular besar dengan kapasitas 39 Ah per sel, menghasilkan elektroda tebal (≈1 cm), pemuatan massa tinggi (≈1,0 g cm −2 ), dan kapasitas areal tinggi (150 mAh cm −2 ). [ 4 , 9 ] Namun, metode ini memerlukan proporsi substansial partikel Ni tidak aktif dalam granula untuk memastikan perkolasi jangka panjang jalur elektron dalam elektroda di semua status pengisian (SoC). Akibatnya, pemanfaatan Ni dalam butiran berbasis partikel yang digunakan dalam sel Na-NiCl₂ komersial biasanya hanya sekitar 30% (rasio massa Ni/NaCl = 1,67), yang mengurangi kapasitas spesifik butiran Ni/NaCl dari nilai teoritisnya sebesar 305 mAh g⁻¹ menjadi ≈160 mAh g⁻¹. [ 4 , 9 ] Akibatnya, energi pelepasan spesifik tipikal dari sel Na-NiCl2 tersebut adalah sekitar 324 Wh kg − 1 , berkenaan dengan massa butiran (160 mAh g −1 , tegangan kesetimbangan rata-rata 2,5 V, 90% kapasitas berputar, efisiensi tegangan 90%). Mengurangi Ni yang tidak aktif dalam butiran berbasis partikel dengan meningkatkan pemanfaatan Ni dapat secara efektif mengatasi biaya dan berat yang terkait. Telah ditunjukkan bahwa sel Na-NiCl2 skala lab yang menggunakan elektroda berbasis partikel dengan pemanfaatan Ni sebesar 40% (rasio massa Ni/NaCl = 1,25) memiliki energi spesifik sebesar 400 Wh kg −1 , tetapi kapasitas sel, efisiensi voltase, dan stabilitas elektrokimia menurun drastis setelah pemanfaatan Ni sebesar 40%. [ 10 ] Mengganti Ni sebagian dengan bahan karbon ditunjukkan sebagai pendekatan lain untuk secara efektif membuat elektroda yang lebih berkelanjutan, meskipun tanpa peningkatan yang nyata dalam energi spesifik. [ 11 ] Namun, hasil menarik yang diperoleh dengan sel Na-NiCl₂ skala lab dengan beban elektroda rendah dan kapasitas areal (50–65 mAh cm −2 ) tidak mudah diterapkan pada baterai komersial, yang memerlukan kapasitas areal yang lebih tinggi, di mana resistansi tambahan memengaruhi siklus hidup dan kinerja sel. [ 12 ]
Mencapai siklus stabil dan peningkatan penggunaan logam bahkan lebih menantang untuk sel Na-ZnCl2 . Penelitian sebelumnya pada sel Na-ZnCl2 skala lab , yang menggunakan elektroda Zn/NaCl berbasis partikel, biasanya menerapkan kapasitas areal 50 mAh cm −2 pada penggunaan Zn≈30%, menghasilkan energi pelepasan spesifik 200–250 Wh kg −1 (misalnya, 160 mAh g −1 , tegangan kesetimbangan rata-rata 2,0 V, 80% kapasitas didaur ulang, efisiensi tegangan 90%). [ 4 ] Sementara butiran Zn/NaCl menyebabkan kegagalan awal pada sel lab planar karena stabilitas mekanis tulang punggung logamnya tidak memadai, peningkatan signifikan dalam stabilitas elektrokimia sel Na-ZnCl2 dicapai dengan menyetel porositas elektroda pada elektroda pelet berbasis partikel, yang menghasilkan siklus stabil selama lebih dari 200 siklus. [ 4 ] Meskipun demikian, butiran Zn/NaCl dapat berhasil diintegrasikan ke dalam sel tubular pada kapasitas areal 150 mAh cm −2 , tetapi hanya ketika membatasi kapasitas siklus di bawah 80%. [ 4c ] Memasukkan serat karbon ke dalam elektroda Zn/NaCl berbasis partikel sebagai pengumpul arus terbukti meningkatkan stabilitas elektroda dengan mencegah penggumpalan Zn pada kapasitas areal hingga 90 mAh cm −2 . [ 13 ] Meskipun modifikasi tersebut secara efektif meningkatkan kinerja siklus elektroda Zn/NaCl skala lab, aplikasi praktis baterai Na-ZnCl 2 memerlukan sel dengan kapasitas areal dan energi spesifik yang lebih tinggi.
Dalam studi ini, pertama-tama kami menyajikan kinerja elektrokimia dari elektroda Zn/NaCl berbasis partikel yang disempurnakan dengan pemanfaatan Zn sebesar 30%, yang diaplikasikan dalam sel Na-ZnCl 2 tubular mutakhir (1,13 g cm⁻ 2 , kapasitas areal 151 mAh cm⁻ 2 ). Energi pelepasan spesifik yang dihasilkan oleh sel Na-ZnCl 2 ini sekitar 278 Wh kg −1 , berkenaan dengan massa Zn dan NaCl, ≈15% lebih rendah daripada sel Na-NiCl 2 mutakhir karena voltase sel yang lebih rendah. Selain itu, sel Na-ZnCl 2 berbasis partikel menunjukkan penurunan efisiensi voltase sebesar 0,7% per siklus.
Bahasa Indonesia: Untuk mencegah penuaan dini dan meningkatkan baik pemanfaatan logam maupun energi spesifik sel Na-ZnCl 2 , kami memperkenalkan desain elektroda inovatif di mana Zn disepuh ke busa Ni, yang secara elektrokimia tidak aktif di jendela tegangan siklus (1,65 – 2,55 V vs Na + /Na). Strategi ini mendapat manfaat dari keberadaan spesies Zn cair yang sangat mobil dan mengatasi beberapa tantangan kritis untuk sel Na-ZnCl 2 : i) Meningkatkan pemanfaatan Zn hingga ≈66%, tanpa mengorbankan efisiensi tegangan. ii) Mencapai kapasitas areal tinggi >200 mAh cm − 2 , bahkan pada beban elektroda yang sedikit menurun (1,04 g cm⁻ 2 ) iii) Meningkatkan stabilitas elektroda positif dengan menyediakan tulang punggung yang stabil untuk pelepasan/pelapisan Zn, menghasilkan efisiensi tegangan yang stabil selama siklus kapasitas kumulatif 5,4 Ah cm − 2 selama 27 siklus. iv) Meningkatkan energi spesifik elektroda Zn/NaCl hingga 50%, dibandingkan dengan elektroda Zn/NaCl berbasis partikel dalam sel tubular, mencapai energi pelepasan spesifik sekitar 424 Wh kg −1 , sehubungan dengan massa Zn dan NaCl.
2 Hasil dan Pembahasan
2.1 Perancangan Elektroda Granul Zn/NaCl Berbasis Partikel pada Sel Tubular
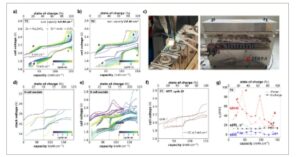
Energi spesifik dan stabilitas siklus sel Na-ZnCl2 menggunakan elektroda Zn/NaCl berbasis partikel granular sangat dipengaruhi oleh proses fabrikasi granular dan desain sel. Dalam studi ini, partikel Zn dan NaCl digranulasi menggunakan peralatan standar industri, diisi ke dalam sel tubular dengan kolektor arus batang Ni, dan direndam dalam NaAlCl4 sebagai elektrolit sekunder melalui infiltrasi vakum ( Gambar 1a ) . Kinerja elektrokimia dari dua sel tubular ekuivalen dengan pemanfaatan Zn 30% dievaluasi pada 300 °C antara 10 dan 100% SoC, menggunakan protokol gabungan arus konstan (CC) dan tegangan konstan (CV) dengan batasan kapasitas (Bagian SI-1a , Informasi Pendukung). Pada kerapatan arus CC 15 mA cm −2 , sel tubular pertama, disingkat T1, menghasilkan energi pelepasan spesifik konstan sebesar 231 Wh kg −1 selama 27 siklus, sementara sel T2 menyediakan 223 Wh kg −1 selama siklus hidup yang lebih pendek, yaitu 15 siklus (Gambar 1b,d ). Energi pelepasan spesifik ini dihitung berdasarkan massa komposit elektroda, yang terdiri dari butiran Zn/NaCl dan pengumpul arus batang Ni. Sehubungan dengan massa butiran Zn/NaCl saja, nilai-nilai ini meningkat sebesar 20%, menjadi 278 Wh kg −1 untuk T1, dan menjadi 268 Wh kg −1 untuk T2. Efisiensi tegangan siklus pertama serupa (89% untuk T1, 88% untuk T2), tetapi peluruhan sebesar 0,7% per siklus diamati dalam siklus berikutnya. Permulaan penurunan kinerja terjadi segera untuk T2, tetapi hanya setelah 10 siklus untuk T1 (Gambar 1b,d ). Resistensi sel rata-rata yang sesuai, dihitung dari efisiensi tegangan, meningkat sebesar 0,5 Ω cm −2 per siklus dari nilai awal 7 Ω cm −2 untuk T1, dan sebesar 0,2 Ω cm −2 per siklus dari 9 Ωcm −2 untuk T2 (Gambar 1c,e ). Sementara kapasitas siklus target sebesar 136 mAh cm −2 (90% SoC) dicapai dengan menggabungkan CC+CV di semua siklus, peningkatan kelebihan potensial sel secara bertahap mengurangi kapasitas pengisian/pengosongan yang tersedia pada CC (Gambar 1c,e ). Untuk kedua sel, permulaan penurunan kinerja berkorelasi dengan akhir siklus CC, yang sesuai dengan pengurangan arus pengisian dan pengosongan selama langkah CV. Secara keseluruhan, sel T1 dan T2 menghasilkan kapasitas pelepasan kumulatif sebesar 4,0 dan 2,6 Ah cm −2 , sekaligus memungkinkan siklus hingga 100% SoC.

Gambar 1
Buka di penampil gambar
Kekuatan Gambar
Variabilitas dalam kinerja siklus dua sel tubular ekuivalen (T1, T2) dengan elektroda positif Zn/NaCl berbasis partikel granular pada pemanfaatan Zn 30%, 300 °C. a) Desain skema sel tubular industri. b,d) Evolusi energi pengisian/pengosongan spesifik elektroda dan efisiensi voltase dengan nomor siklus, untuk sel T1 dan T2. c,e) Evolusi kapasitas siklus oleh CC+CV, kapasitas siklus oleh CC saja, dan resistansi sel rata-rata dengan nomor siklus, untuk sel T1 dan T2.
Kinerja elektrokimia dari elektroda Zn/NaCl berbasis partikel yang diproses pada granulator skala produksi industri secara signifikan melampaui hasil sebelumnya yang diperoleh pada granulator skala lab, [ 4 ] yang mengonfirmasi pentingnya proses granulasi pada kinerja sel. Selain itu, distorsi yang diamati dalam profil tegangan untuk kedua sel terjadi selama siklus di wilayah (a, b, c, d), yang menunjukkan bahwa mekanisme yang sama bertanggung jawab atas penuaan sel ( Gambar 2 a,b ). Meskipun demikian, laju pemudaran efisiensi tegangan dan stabilitas siklus berbeda antara dua sel. Hal ini kemungkinan besar disebabkan oleh variasi dalam arsitektur elektroda positif, yang menyebabkan perbedaan dalam perkolasi tulang punggung logam Zn, distribusi fase aktif, dan jalur ionik dalam elektrolit NaAlCl4 sekunder .
Gambar 2
Buka di penampil gambar
Kekuatan Gambar
Evaluasi profil tegangan untuk sel tubular (T1, T2) dan siklus modul 8 sel dengan elektroda positif Zn/NaCl berbasis partikel pada 300 °C. Evolusi tegangan sel untuk T1 dengan SoC dan nomor siklus a) T1, dan b) T2. c) Perakitan dan pengaturan modul 8 sel dengan sel yang setara dengan T1 dan T2. d) Evolusi tegangan tumpukan untuk modul 8 sel dengan SoC dan nomor siklus. e) Evolusi yang sesuai dari tegangan sel individual dari modul 8 sel dengan SoC dan nomor siklus. f) Perbandingan profil tegangan untuk siklus GITT 29 dan siklus 1, keduanya dilakukan pada kerapatan arus CC 5 mA cm −2 . g) Pemisahan kelebihan potensial sel menjadi kontribusi ohmik yang bergantung arus dan transfer muatan η(ct), serta kontribusi transfer massa yang tidak bergantung arus η(mt), yang diperoleh dari evaluasi waktu istirahat dalam siklus GITT.
Perbedaan dalam kinerja sel menghadirkan tantangan tertentu saat penskalaan dari level sel ke level baterai. Memastikan keseragaman dalam elektroda Zn/NaCl berbasis partikel merupakan tantangan, dan bahkan variasi kecil dapat menyebabkan perbedaan signifikan dalam kinerja dan keandalan. Untuk menilai aplikasi praktis baterai Na-ZnCl2 , delapan sel, setara dengan T1 dan T2, dihubungkan secara seri dalam satu modul, menyediakan energi nominal 0,63 kWh (39,2 Ah, pada 2,0 V) (Gambar 2c ). Untuk menghindari pengisian daya pada tegangan sel tinggi, tegangan batas dikurangi menjadi 18,8 V, yang sesuai dengan 2,35 V per sel rata-rata, dan kerapatan arus CC dikurangi menjadi 10 mA cm −2 saat mendaur ulang modul. Meskipun modul gagal selama pelepasan pada siklus ke-5 karena elektrolit padat yang rusak dalam satu sel (Gambar S8 , Informasi Pendukung), tidak ada masalah keamanan, karena pada jenis baterai ini, pintasan antara elektroda tidak menimbulkan risiko pelarian termal. Analisis profil tegangan masing-masing sel menunjukkan variasi yang signifikan, dengan tegangan sel melebihi 2,8 V dalam sel tunggal (Gambar 2d,e ). [ 14 ] Potensial sel yang tinggi tersebut diketahui dapat memicu reaksi samping yang tidak diinginkan, seperti dekomposisi NaAlCl 4 . [ 11 , 14 ]
Memahami variasi sel-ke-sel dan mekanisme penuaan sel Na-ZnCl2 dengan elektroda Zn/NaCl berbasis partikel granular sangat penting untuk mengembangkan desain elektroda baru dan meningkatkan stabilitas siklus baterai ini. Arsitektur dan jalur reaksi elektrokimia dalam elektroda positif memainkan peran penting dalam proses ini. Profil tegangan sel Na-ZnCl2 diatur oleh reaksi redoks Zn dalam keberadaan lingkungan anion klorin, klorinasi/de-klorinasi Na2ZnCl4 padat nominal di bawah 50% SoC, dan de-/klorinasi lelehan Zn2+ berbasis klorida di atas 50% SoC (Bagian SI-1a , Informasi Pendukung). Dengan demikian, setiap gangguan dalam transfer ion ke antarmuka elektroda/elektrolit menghasilkan kelebihan potensial sel. Teknik titrasi intermiten galvanostatik (GITT) yang dikombinasikan dengan spektroskopi impedansi dilakukan selama siklus 29 pada T1 untuk mengidentifikasi penyebab kelebihan potensial sel. Hasil menunjukkan bahwa keterbatasan transportasi massa di daerah (a, b, d) dan resistansi ohmik di daerah (c) mendistorsi kurva pengisian/pengosongan T1 (Gambar 2a,b,f,g ; Bagian SI-1b,c , Informasi Pendukung). Keterbatasan transfer massa mungkin berasal dari perubahan arsitektur elektroda positif selama siklus, termasuk variasi jalur ionik dalam elektrolit NaAlCl4 sekunder ( porositas) dan luas permukaan elektroaktif. Ini menjadi jelas ketika membandingkan penampang mikroskop elektron pemindaian (SEM) dari elektroda positif T2 setelah siklus dengan sel baru ( Gambar 3 a,b ; Bagian SI–1d , Informasi Pendukung). Karakterisasi morfologi elektroda positif menunjukkan bahwa butiran berukuran mm yang saling berhubungan dalam elektroda baru telah hancur sepenuhnya (Gambar 3d,e , daerah 1–3). Selain itu, gradien lateral dalam konsentrasi material elektroaktif terbentuk setelah siklus, yang meluas dari area dekat elektrolit padat (Gambar 3f,i wilayah 1) ke kolektor arus batang Ni di bagian tengah elektrode positif (Gambar 3h,k wilayah 3). Lebih jauh lagi, partikel Zn bulat murni berdiameter ≈5 µm diaglomerasi menjadi partikel yang lebih besar (misalnya, 60 µm) di seluruh wilayah elektrode positif, yang menunjukkan konsumsi Zn bulat yang lebih kecil secara terus-menerus selama siklus (bandingkan Gambar 3h,k , sisipan).

Gambar 3
Buka di penampil gambar
Kekuatan Gambar
Perubahan dalam arsitektur elektroda dari elektroda positif Zn/NaCl berbasis partikel setelah didaur ulang. Foto a) elektroda yang tidak didaur ulang dan b) elektroda yang didaur ulang (T2) menunjukkan elektroda positif pada 0% SoC. c) Skema menyorot segmen elektroda positif yang dipisahkan untuk analisis morfologi. Pandangan global dari bagian horizontal elektroda butiran Zn/NaCl berbasis partikel ditunjukkan dalam d) untuk elektroda yang tidak didaur ulang dan e) untuk elektroda yang didaur ulang (T2). Gambar SEM dari wilayah (1), yang terletak di dekat elektrolit padat, disajikan dalam f) untuk elektroda yang tidak didaur ulang dan i) untuk elektroda yang didaur ulang. Gambar SEM dari wilayah (2) ditunjukkan dalam g) untuk elektroda yang tidak didaur ulang dan dalam j) untuk elektroda yang didaur ulang. Akhirnya, gambar SEM dari wilayah (3), yang terletak di dekat pengumpul arus batang Ni di bagian tengah elektroda, ditunjukkan dalam h) untuk elektroda yang tidak didaur ulang dan dalam k) untuk elektroda yang didaur ulang.
Perubahan parah dalam arsitektur elektroda, sepanjang tinggi dan dimensi lateral, dan disintegrasi granula saat pengayunan dikaitkan dengan proses konversi elektrokimia dalam sel Na-ZnCl2 , yang melibatkan pembentukan spesies cair (Bagian SI-1a , Informasi Pendukung). Memang, garam Zn2 + berbasis klorida cair cenderung terakumulasi di dasar sel tubular karena kepadatannya yang lebih tinggi dibandingkan dengan garam elektrolit NaAlCl₄ cair sekunder. Masalah ini cukup jelas dalam elektroda berbasis partikel, di mana granula yang saling berhubungan berfungsi sebagai tulang punggung elektronik dan bahan elektroaktif. Dengan demikian, disintegrasi granula mengganggu transfer elektron, yang menyebabkan reduksi ion Zn2 + yang tidak seragam selama pelepasan dan penggumpalan partikel. Selain itu, migrasi ion Zn2⁺ menuju elektroda negatif selama pengisian, diikuti oleh reduksi yang tidak seragam saat pelepasan, menciptakan gradien lateral pada elektroda positif.
Meskipun granulasi memberikan sel baterai Na-NiCl 2 stabilitas siklus yang tinggi, [ 8 , 14 , 15 ] butiran Zn/NaCl tidak secara efektif meningkatkan stabilitas sel Na-ZnCl 2 karena karakteristik Zn yang berbeda dibandingkan dengan Ni. Selain itu, penambahan partikel seng yang tidak aktif dalam proporsi tinggi untuk memastikan jalur elektron yang meresap pada 100% SoC menurunkan kapasitas spesifik elektroda butiran Zn/NaCl.
2.2 Desain Elektroda Zn/NaCl Berbasis Busa dalam Perakitan Sel Planar
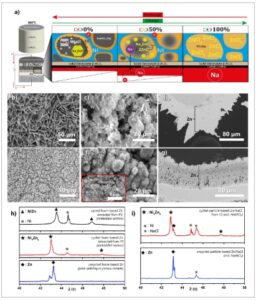
Untuk mengatasi masalah yang teridentifikasi, elektroda yang baru dirancang (Zn/NaCl) dikembangkan, yang hanya berfungsi sebagai bahan elektroaktif. Batang Ni dalam sel tubular digantikan oleh busa Ni (porositas lebih dari 95% dan diameter pori 1–2 mm) ( Gambar 4 a,b ) ZincZn (0,38 g cm −2 ) dilapisi secara seragam ke busa Ni dengan pemuatan tinggi dan tanpa penggumpalan (Gambar 4c ). Pemanfaatan Zn dari elektroda Zn/NaCl berbasis busa disesuaikan dengan menambahkan jumlah NaCl yang sesuai. Ketika merakit elektroda Zn berbasis busa dengan kapasitas areal tinggi pada suhu kamar, pengepakan partikel padat NaCl dan NaAlCl₄ melebihi ketebalan busa (Gambar 4d ). Pada suhu 300 °C, NaAlCl₄ cair memungkinkan migrasi muatan Cl⁻ dan Na⁺ menuju tulang punggung elektron dari elektroda positif dan elektroda negatif, masing-masing, sehingga mencapai kapasitas teoritis yang ditentukan oleh konsumsi penuh NaCl. Mekanisme ini memungkinkan sel Na-ZnCl₂ dengan elektroda Zn/NaCl berbasis busa untuk mencapai kapasitas areal yang tinggi tanpa menambah berat busa Ni yang tidak aktif secara elektrokimia (Bagian SI_2a,b , Informasi Pendukung).

Gambar 4
Buka di penampil gambar
Kekuatan Gambar
Konsep desain elektroda Zn/NaCl berbasis busa. a) Foto busa Ni dengan porositas >95%, diameter pori 1–2 mm. b) Gambar SEM busa Ni yang memperlihatkan rangka polos yang saling terhubung. c) Gambar SEM elektroda Zn berbasis busa (namun tanpa NaCl), yang merepresentasikan struktur seng berlapis elektro seragam pada rangka busa Ni. d) Skema elektroda Zn/NaCl berbasis busa dalam sel planar pada suhu ruangan dan pada 300 °C (suhu pengoperasian), yang diinfiltrasi dengan NaAlCl4 . Mekanisme elektrokimia melibatkan migrasi ion pada elektroda positif, yang menghasilkan konsumsi penuh NaCl.
Karakteristik elektrokimia Zn/NaCl berbasis busa dievaluasi dalam tiga sel skala lab planar, disingkat P1, P2, dan P3, dengan kapasitas areal lebih dari 200 mAh cm −2 . Setelah menerapkan modifikasi di kompartemen anoda untuk memungkinkan kompatibilitas dengan volume besar Na (Bagian SI_2c,d , Informasi Pendukung), sel planar tersebut mendukung kapasitas areal yang tinggi, bahkan melampaui sel tubular komersial.
Sel P1 dengan elektroda Zn/NaCl berbasis busa dengan pemanfaatan Zn ≈71% dan kapasitas areal teoritis sebesar 219 mAh cm⁻ 2 , menunjukkan kapasitas siklus tinggi sebesar 178 mAh cm⁻ 2 , yang menghasilkan energi pelepasan spesifik yang tinggi sebesar 318 Wh kg⁻¹ pada tingkat komposit elektroda ( Gambar 5 a,b ). Nilai ini mencakup massa busa Ni; dengan hanya mempertimbangkan Zn dan NaCl, energi pelepasan spesifik meningkat sebesar 22%, menjadi 386 Wh kg −1 . Dibandingkan dengan T1 dan T2, energi spesifik yang dihasilkan oleh P1 masing-masing sebesar 37% dan 42% lebih tinggi (Gambar 1b,c ), meskipun beban elektroda sedikit lebih rendah (1,04 g cm⁻ 2 untuk P1, 1,13 g cm⁻ 2 untuk T1 dan T2). Sel menunjukkan siklus yang berhasil selama 22 siklus dengan kapasitas siklus kumulatif sebesar 3,9 Ah cm⁻ 2 pada 10 mA cm⁻ 2 . Hasil ini mengonfirmasi kemampuan desain elektroda Zn/NaCl berbasis busa untuk meningkatkan pemanfaatan logam tanpa mengorbankan efisiensi voltase (Gambar 5a,b ), yang penting untuk aplikasi praktis baterai Na-ZnCl₂ (Bagian SI_2c , Informasi Pendukung). Namun, resistansi sel yang relatif tinggi sebesar 13–14 Ω cm −2 untuk P1 (Gambar 5c ) mencegah tercapainya kapasitas teoritis. Menurut analisis impedansi, ini berasal dari lapisan interlayer resistif pada antarmuka antara elektrolit padat dan elektroda negatif Na cair (Bagian SI_2d , Informasi Pendukung). Gambar S12b (Informasi Pendukung) menunjukkan, setelah pengisian pertama, setengah lingkaran dengan waktu relaksasi 3,7 kHz muncul, meningkat dengan siklus dan mendominasi impedansi sel keseluruhan setelah 21 siklus. Perilaku ini mungkin merupakan indikasi terbentuknya lapisan pasivasi pada antarmuka elektrolit padat/elektroda negatif, yang menghambat pengangkutan ion Na⁺ melalui elektrolit padat pada 10% SoC.
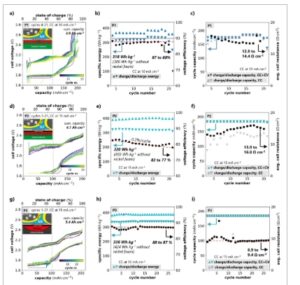
Gambar 5
Buka di penampil gambar
Kekuatan Gambar
Kinerja siklus sel planar (P1, P2, P3) dengan elektroda positif Zn/NaCl berbasis busa pada pemanfaatan Zn 66–71%, 300 °C a) Penampang skematis sel planar P1 dengan kolektor Na bergelombang, dan profil tegangan naik pada siklus. b) Evolusi energi pengisian/pengosongan spesifik elektroda dan efisiensi tegangan dengan nomor siklus untuk P1. c) Evolusi kapasitas siklus oleh CC+CV, kapasitas siklus oleh CC saja, dan resistansi sel rata-rata dengan nomor siklus, untuk sel P1. d) Penampang skematis sel planar P2 dengan elektrolit padat berlapis karbon dan kolektor Na bergelombang, dan profil tegangan P2 saat siklus. e) Evolusi energi pengisian/pengosongan spesifik elektroda dan efisiensi tegangan dengan nomor siklus untuk P2. f) Evolusi kapasitas siklus (pengisian/pengosongan) oleh CC+CV, kapasitas siklus oleh CC saja, dan resistansi sel rata-rata dengan nomor siklus, untuk sel P2. g) Penampang skema sel planar P3 dengan kolektor Na berbentuk elips, dan profil tegangan P3 naik pada siklus. h) Evolusi energi pengisian/pengosongan spesifik elektroda dan efisiensi tegangan dengan nomor siklus untuk P3. i) Evolusi kapasitas siklus oleh CC+CV, kapasitas siklus oleh CC saja, dan resistansi sel rata-rata dengan nomor siklus, untuk sel P3.
Cara yang efisien untuk mengatasi resistansi ini adalah dengan melapisi elektrolit padat dengan lapisan karbon tebal dan stabil ke arah elektrode negatif. [ 16 ] Ini menstabilkan antarmuka Na cair/elektrolit padat, yang memungkinkan siklus elektrokimia pada 15 mA cm −2 (Gambar 5d ; Bagian SI_2d , Informasi Pendukung). Dalam rakitan sel planar yang disempurnakan, P2 mengaktifkan kapasitas teoritis sebesar 205 mAh cm −2 , menghasilkan energi pelepasan spesifik yang lebih tinggi sebesar 320 Wh kg −1 (termasuk busa Ni; 403 Wh kg −1 hanya untuk Zn dan NaCl). Pengisian daya P2 yang berhasil hingga kapasitas teoritis pada overpotensial rendah (Gambar 5d ) menunjukkan desain elektroda ini untuk memungkinkan kombinasi kapasitas areal tinggi pada pemanfaatan Zn tinggi. Meskipun demikian, siklus elektrokimia P2 antara 10–100% SoC pada 15 mA cm⁻ 2 menunjukkan penurunan efisiensi tegangan sebesar 0,2% per siklus selama 22 siklus (Gambar 5e ), mirip dengan T1. Selain itu, resistansi sel sebesar 13–17 Ω cm⁻ 2 menyoroti polarisasi pelepasan yang signifikan pada kerapatan arus tinggi sebesar 15 mA cm⁻ 2 (Gambar 5f ; Bagian SI_2e , Informasi Pendukung).
Dalam desain sel planar, saat Na cair terakumulasi di bagian bawah, tegangan pelepasan tinggi diperlukan untuk mengembalikan Na yang dihasilkan dari elektrode negatif ke elektrode positif. Selain itu, interaksi rendah antara Na cair dan kolektor Na sangat penting. Reversibilitas sel dengan mengembalikan Na cair yang dihasilkan ke elektrode positif menjadi sulit pada pemuatan elektrode tinggi, memerlukan desain kolektor Na yang lebih baik untuk mencapai efisiensi tegangan tinggi (Bagian SI_2f , Informasi Pendukung). Untuk tujuan ini, kolektor Na berbentuk elips 3D yang baru dirancang (Bagian SI_2f , Informasi Pendukung) digunakan dalam P3, sambil mempertahankan pemuatan elektrode yang sama seperti P2 (Gambar 5g ). Sebagai hasil dari peningkatan kelebihan potensial pelepasan, P3 menghasilkan energi pelepasan spesifik tinggi sebesar 336 Wh kg −1 pada 15 mA cm −2 (termasuk busa Ni; 424 Wh kg −1 hanya untuk Zn dan NaCl). Ini sesuai dengan peningkatan 45% dalam energi spesifik sel dibandingkan dengan sel dengan elektroda Zn/NaCl berbasis partikel granular. Efisiensi tegangan yang stabil dengan peluruhan yang dapat diabaikan selama 27 siklus mengonfirmasi stabilitas elektroda positif dalam desain sel yang ditingkatkan (Gambar 5h ). Resistansi sel yang dihitung ditingkatkan menjadi 9 Ω cm −2 untuk P3, dengan peningkatan yang dapat diabaikan per siklus selama 27 siklus. Peningkatan ini berasal dari peningkatan kelebihan potensial pelepasan, karena kapasitas siklus dikirimkan oleh CC dalam semua siklus (Gambar 5g,i ; Bagian SI_2d , Informasi Pendukung). Karena resistansi sel yang dibahas di sini dihitung dari efisiensi tegangan pada kerapatan arus pengisian/pengosongan yang diberikan, besarnya umumnya dipengaruhi oleh kontribusi dari elektroda negatif, elektrolit, dan elektroda positif. Perubahan bertahap yang terjadi dalam sepuluh siklus pertama di P3, begitu pula keterbatasan yang hanya ada dalam siklus tertentu, misalnya dalam siklus 6 dan 12, disebabkan oleh potensi berlebih yang berasal dari elektrode negatif, misalnya antarmuka Na cair/elektrolit padat.
Dalam sel planar yang dioptimalkan, elektroda Zn/NaCl berbasis busa menunjukkan peningkatan resistansi yang dapat diabaikan dibandingkan dengan elektroda Zn/NaCl berbasis partikel granular pada kerapatan arus yang sama, sambil mencapai kapasitas areal yang lebih tinggi. Keterbatasan dalam desain sel planar, seperti kebocoran Na pada sel berkapasitas tinggi, secara signifikan memengaruhi kinerja dan saat ini masih menghambat siklus jangka panjang. Meskipun demikian, sel P1, P2, dan P3 menunjukkan kapasitas siklus kumulatif masing-masing sebesar 3,9, 4,2, dan 5,4 Ah cm⁻ 2 . Hal ini menunjukkan bahwa elektroda yang baru dirancang menghasilkan kapasitas areal yang tinggi, energi spesifik yang ditingkatkan, efisiensi tegangan yang stabil, dan reversibilitas yang sangat baik pada kerapatan arus yang tinggi, sehingga membuatnya cocok untuk aplikasi praktis.
Stabilitas elektrokimia tinggi yang diperoleh dengan elektroda Zn/NaCl berbasis busa dihasilkan dari perkolasi jalur elektron yang stabil di semua SoC ( Gambar 6 a ), mencegah penggumpalan Zn selama siklus. Ini kontras dengan elektroda Zn/NaCl berbasis partikel, di mana partikel Zn cenderung menggumpal. Analisis morfologi post-mortem dari Zn berbasis busa mengungkapkan distribusi homogen struktur Zn dengan dimensi lebih kecil daripada yang tidak didaur ulang, mengonfirmasi efektivitas strategi kami dalam mencegah penggumpalan Zn dan memfasilitasi pembentukan struktur Zn dengan luas permukaan elektroaktif tinggi (bandingkan Gambar 6b,c dan Gambar 6d,e ). Selain itu, perbandingan penampang sebelum dan sesudah siklus menunjukkan struktur Zn berlapis seragam di sekitar tulang punggung Ni, yang menampilkan porositas lebih tinggi daripada pada struktur yang tidak didaur ulang (Gambar 6f,g ). Ini karena pelapisan struktur Zn dengan luas permukaan tinggi lebih disukai pada tulang punggung elektron. [ 17 ]
Gambar 6
Buka di penampil gambar
Kekuatan Gambar
Struktur dan pembentukan fase dalam elektroda positif Zn/NaCl setelah pengayunan. a) Skema yang menyajikan pembentukan fase dalam sel planar dengan elektroda Zn/NaCl berbasis busa, dengan fokus pada fase padat Na2ZnCl4 dan ZnCl2 masing – masing pada 50% dan 100% SoC. b–d) Gambar SEM yang mengilustrasikan morfologi permukaan dan penampang melintang struktur Zn murni yang dilapisi. e–g ) Gambar SEM yang mengilustrasikan morfologi permukaan dan penampang melintang struktur Zn setelah pengayunan, yang menyoroti ketebalan Zn berlapis dan porositasnya. h) Difraktogram XRD elektroda Zn baru dan yang telah diayunkan (diekstraksi dari P2 dan P3, penampang tertanam setelah penghilangan NaAlCl4 ) . i) Difraktogram XRD elektroda Zn/NaCl berbasis partikel baru dan yang telah diayunkan (diekstraksi dari T2, termasuk NaAlCl4 ) .
Analisis kandungan fasa mengungkapkan bahwa struktur Zn telah berubah menjadi fasa Zn-Ni intermetalik setelah didaur ulang (Gambar 6h ; lihat Gambar S7, S9, S20 , Informasi Pendukung untuk detailnya). Fenomena ini, juga diamati dalam butiran berbasis partikel (Gambar 6i ), kemungkinan besar disebabkan oleh penggabungan Ni dari pengumpul arus. Zn dan Ni dalam kontak langsung diketahui mengalami reaksi antarmuka, yang dapat terjadi secara independen dari aliran arus. [ 18 ] Namun, terlepas dari fasa yang terbentuk, transformasi ini tidak memengaruhi kinerja elektrokimia sel, yang mengonfirmasi bahwa hanya Zn yang berkontribusi pada reaksi elektrokimia (Bagian S_2g , Informasi Pendukung).
3 Kesimpulan
Dalam studi ini, kami membandingkan kinerja elektrokimia dari dua desain elektroda: butiran Zn/NaCl dengan pemanfaatan Zn 30% dan elektroda Zn/NaCl berbasis busa yang baru dirancang, keduanya dengan beban elektroda ≈1 g cm⁻ 2 . Sel dengan elektroda Zn/NaCl berbasis busa dan kapasitas area di atas 200 mAh cm −2 mencapai pemanfaatan Zn ≈66%, menghasilkan peningkatan substansial dalam energi pelepasan spesifik, dibandingkan dengan sel dengan butiran Na/ZnCl₂, menghasilkan 336 Wh kg⁻¹ pada 15 mA cm⁻ 2 (termasuk massa busa Ni dalam massa referensi; 424 Wh kg⁻¹ sehubungan dengan Zn dan NaCl saja). Selain itu, menggunakan Zn secara eksklusif sebagai bahan aktif elektrokimia memberikan efisiensi tegangan stabil sebesar 87% selama siklus kapasitas kumulatif 5,4 Ah cm⁻ 2 . Hal ini menunjukkan peningkatan substansial dibandingkan sel dengan butiran Zn/NaCl, di mana efisiensi tegangan awal sebesar 88% menurun sebesar 0,7% per siklus. Penerapan kolektor arus stabil yang memungkinkan pelepasan dan pelapisan Zn selama pengisian dan pengosongan menghasilkan struktur yang lebih berpori pada elektroda berbasis busa. Sebaliknya, butiran Zn/NaCl mengalami penggumpalan Zn, yang menurunkan efisiensi tegangan.
Percobaan lebih lanjut harus difokuskan pada perakitan elektroda Zn/NaCl berbasis busa dalam desain sel tubular yang secara efektif mengelola Na cair, yang menjanjikan kemajuan signifikan dalam siklus hidup sel Na-ZnCl₂. Penyempurnaan porositas dan morfologi elektroda berbasis busa dapat memungkinkan peningkatan lebih lanjut dari beban massa Zn, sekaligus mengurangi berat material yang tidak aktif. Bersama dengan peningkatan pemanfaatan logam aktif hingga 100%, elektroda tersebut dapat secara substansial meningkatkan kapasitas areal bahkan pada beban massa yang berkurang. Optimalisasi ini tidak hanya menurunkan biaya sel tetapi juga mengurangi komponen yang tidak aktif dalam sistem sebagai langkah lebih lanjut untuk mengembangkan baterai Na-ZnCl2 dengan energi spesifik yang tinggi.
4 Bagian Eksperimen
Granul Zn/NaCl Berbasis Partikel
Butiran elektrode positif berbasis partikel disiapkan dari 65,1 wt.% Zn (ukuran partikel rata-rata 4,5 µm, debu Zn Ultramurni UP4 dari Purity zinc metals, AS) dan 34,9 wt.% NaCl (mikrohalus/digiling, distribusi ukuran partikel 88 wt.% <45 µm, kemurnian 99,1–99,4%), seperti yang dijelaskan secara rinci dalam publikasi sebelumnya. [ 4 ] Setelah konsumsi NaCl secara lengkap pada 100% SoC, ini menghasilkan pemanfaatan Zn sebesar 30%, yang menyediakan kapasitas spesifik sebesar 160 mAh g −1 terhadap massa Zn dan NaCl. Dalam penelitian ini, peralatan manufaktur skala besar Horien digunakan untuk meningkatkan produksi butiran ke ukuran batch yang lebih besar yaitu 10 kg. Serbuk Zn dan NaCl digabungkan dalam wadah menggunakan pemutar tabung, diikuti dengan penggulungan wadah selama 4 jam. Campuran yang dihasilkan dimasukkan ke dalam jalur produksi melalui hopper loader, di mana campuran tersebut dipadatkan menjadi serpihan oleh rol. Serpihan ini kemudian dihancurkan dalam granulator, dan butiran yang dihasilkan disortir menjadi fraksi partikel yang sesuai menggunakan saringan getar. Partikel yang lebih besar (diameter >1,6 mm) dihilangkan, dan fraksi halus (<212 µm) disesuaikan menjadi 2,1 wt.%, sehingga menghasilkan kerapatan keran sebesar 1,88 g cm −2 .
Perakitan Sel dan Modul Tubular
Sepuluh sel tubular disiapkan menggunakan tabung Na-β″-alumina bergelombang sebagai elektrolit padat, tertutup di bagian bawah, menyediakan area sel aktif 260 cm −2 . Batang Ni terlipat (diameter 4 mm, 49 g) dimasukkan ke dalam setiap tabung sebagai pengumpul arus untuk elektrode positif. Tabung diisi dengan 245 g butiran Zn/NaCl, menghasilkan kapasitas sel 39,2 Ah, dan kapasitas areal 151 mAh cm −2 . Mempertimbangkan butiran Zn/NaCl dan pengumpul arus batang Ni untuk massa referensi, kapasitas pada tingkat komposit elektroda berjumlah 133 mAh g −1 untuk pemuatan massa 1,13 g cm −2 , dan pemanfaatan logam yang sesuai berjumlah 22%. Elektrode positif kemudian diinfiltrasi dengan 90 g NaAlCl4 cair sebagai elektrolit sekunder (0,35 g cm −2 ). Perakitan sel dari sel tubular bebas anoda dilanjutkan dalam alur kerja produksi Horien, termasuk penyegelan kedap udara. Kinerja elektrokimia dari dua sel tubular ini (T1, T2) dipelajari secara individual, dan sel tubular lainnya dihubungkan secara seri dalam sebuah modul (dengan probe tegangan terpasang pada setiap sel) untuk mengevaluasi aplikasi praktis butiran Zn/NaCl berbasis partikel dalam baterai Na-ZnCl 2. Siklus sel elektrokimia dilakukan dalam tungku di bawah kondisi udara sekitar.
Elektroda Zn Berbasis Busa
Busa Ni yang sangat berpori (porositas 95%, diameter pori 1–2 mm, dan ketebalan 5–6 mm) digunakan sebagai kolektor arus 3D (lihat Tabel 1 a ). Busa dipotong dengan laser hingga berukuran 30 mm × 30 mm untuk proses pelapisan listrik. Setelah pra-perlakuan dengan 37% HCl dan etanol, busa Ni digunakan sebagai elektroda kerja, dipasangkan dengan pelat Zn (kemurnian 99%) sebagai elektroda lawan (dimensi: 40 mm × 40 mm × 5 mm). Mandi elektroplating disiapkan dari 180 g L −1 ZnSO4.7H2O (kemurnian 99%), 30 g L −1 NaCl, 25 g L −1 H3BO3 (kemurnian 99,5%), dan 0,4 g L −1 polioksietilen lauril eter (C12H25O ( CH2CH2O ) 9H ) yang berfungsi sebagai surfaktan nonionik. Proses elektroplating dilakukan di bawah rapat arus 25 mA cm −2 dalam kondisi yang diatur pada 40 °C, menggunakan catu daya bench top (QL355 ) . Setelah pelapisan, busa Ni berlapis Zn (Zn berbasis busa) dibersihkan secara menyeluruh menggunakan mandi ultrasonik dengan etanol dan air deionisasi (DI). Langkah pembersihan ini penting untuk menghilangkan garam sisa dari larutan elektroplating dan partikel yang terlepas. Setelah dibersihkan, busa dikeringkan pada suhu 100 °C selama beberapa jam dalam kondisi ruangan, diikuti dengan pengeringan vakum semalaman untuk meminimalkan pembentukan seng oksida pada permukaan. Untuk integrasi ke dalam sel planar, busa kemudian dilubangi menjadi cakram bundar dengan diameter 20 mm. Pemuatan Zn di area 3,14 cm 2 ditentukan dengan mengukur massa elektroda Zn berbasis busa bundar. Karena variasi dalam kepadatan busa Ni, pencucian asam berikutnya, dan pemisahan cakram bundar dari tengah busa untuk menghindari struktur Zn berlapis yang tidak homogen, pengukuran yang tepat dari dimensi substrat menjadi tantangan; namun, ada pengurangan dalam pemuatan busa Ni sebesar ≈22% dari nilai aslinya, yang digunakan untuk menghitung massa Zn. Dalam penelitian ini, elektroplating dilakukan selama 24 jam untuk semua sampel, menghasilkan massa Zn sebesar ≈0,38 g cm − 2 , berdasarkan area sel aktif sebesar 3,14 cm 2 .
Tabel 1. a) Karakteristik busa Ni yang digunakan dalam sel Zn/NaCl planar. b) Spesifikasi sel tubular dan planar, relatif terhadap luas elektroda aktif dan massa elektroda Zn/NaCl.
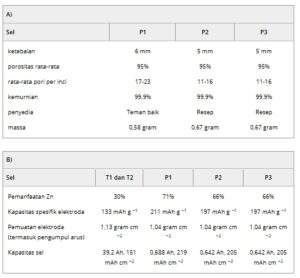
Persiapan Elektroda Positif untuk Sel Planar
Penelitian elektrokimia elektroda Zn berbasis busa dilakukan dalam rakitan sel suhu tinggi skala laboratorium planar (luas sel aktif = 3,14 cm 2 ) di mana cakram elektrolit Na-β″-alumina (ketebalan 1 mm, konduktivitas ion 0,2 S cm −1 pada 300 °C) diapit di antara dua kerah α-alumina isolasi menggunakan segel kaca, seperti yang dilaporkan sebelumnya. [ 8 , 16 ]
Tiga jenis elektroda planar disiapkan: P1, P2, dan P3 (Tabel 1b ). Zn berbasis busa dihubungkan secara elektrik dengan kawat Ni (ketebalan 1 mm) dan ditempatkan dengan hati-hati dalam kontak fisik dengan elektrolit padat. Setelah itu, campuran mortar NaCl dan bubuk elektrolit sekunder (NaAlCl4 ) ditambahkan ke kompartemen katode. Untuk P1, elektroda Zn berbasis busa 0,56 g cm −2 dicocokkan dengan 0,48 g cm −2 NaCl dan 1,91 g cm −2 NaAlCl₄, menyediakan kapasitas sel 0,688 Ah, dan kapasitas areal 219 mAh cm −2 . Beban komposit elektroda keseluruhan, termasuk busa Ni, adalah 1,04 g cm −2 , menyediakan kapasitas spesifik 211 mAh g −1 pada pemanfaatan logam 46%. Hanya dengan mempertimbangkan massa Zn dan NaCl, tanpa mempertimbangkan keberadaan busa Ni ≈0,18 g cm − 2 , kapasitas spesifik meningkat hingga 257 mAh g −1 pada pemanfaatan Zn sebesar 71%.
Untuk P2 dan P3, elektroda Zn berbasis busa sebesar 0,67 g cm −2 dipadukan dengan jumlah NaCl yang sedikit lebih rendah (0,45 g cm −2 ) NaCl dan NaAlCl₄ (1,59 g cm −2 ), yang menyediakan kapasitas sel sebesar 0,642 Ah, dan kapasitas areal sebesar 205 mAh cm −2 . Beban elektroda keseluruhan serupa (1,04 g cm −2 ), yang menyediakan kapasitas spesifik elektroda sebesar 197 mAh g −1 karena pemanfaatan logam yang sedikit lebih rendah sebesar 40%. Sehubungan dengan massa Zn dan NaCl, tidak mempertimbangkan keberadaan busa Ni ≈0,21 g cm −2 , kapasitas spesifik untuk P2 dan P3 berjumlah 248 mAh g −1 pada pemanfaatan Zn sebesar 66%.
Campuran mortar NaCl dan NaAlCl₄ diaduk ke dalam elektroda Zn berbasis busa dengan pengadukan dan penyadapan menyeluruh. Kemudian elektroda positif dipanaskan hingga 200 °C dalam vakum selama 1 jam untuk menghilangkan gas yang terperangkap dan memungkinkan infiltrasi lengkap 3D-Zn berbasis busa dengan elektrolit sekunder NaAlCl₄ cair. NaAlCl₄ dalam jumlah berlebih diaplikasikan untuk memastikan pembasahan optimal semua bahan aktif, termasuk beberapa NaCl yang tersisa di atas elektroda 3D-Zn berbasis busa dalam sel murni. Setelah pendinginan alami, silinder Ni yang sesuai dengan diameter bagian dalam kerah α-alumina dihubungkan ke elektroda Zn berbasis busa dengan kabel Ni.
Sebagai perbandingan, elektrode positif dibuat dengan metode yang sama hanya menggunakan kolektor arus busa Ni polos, tanpa lapisan Zn, bersama dengan 0,22 g cm −2 NaCl dan 0,95 g cm −2 NaAlCl 4 . Dengan asumsi klorinasi Ni dalam sel Na-NiCl 2 , ini sesuai dengan pemanfaatan Ni sebesar 40% (55,5 wt.% Ni dan 44,5 wt.% NaCl), yang menyediakan kapasitas spesifik elektrode teoritis sebesar 204 mAh g −1 , dan kapasitas sel sebesar 0,317 Ah.
Persiapan Kompartemen Elektroda Negatif
Di kompartemen anoda P1, cakram tipis Na ditekan langsung ke permukaan elektrolit Na-β′-alumina kosong dan disegel dengan kolektor Na bergelombang yang terbuat dari aluminium (kolom persegi dengan panjang sisi 1 mm dan tinggi 3 mm, berjarak 1 mm). [ 14 ] Selama perakitan sel P2 dan P3, sisi anoda elektrolit padat dilapisi karbon untuk meningkatkan pembasahan permukaan dengan Na cair. [ 16 ] Untuk P1, kolektor Na bergelombang digunakan, seperti di atas. Untuk P3, kolektor Na berbentuk elips 3D yang baru dirancang digunakan untuk menyegel Na yang melekat pada elektrolit padat berlapis karbon (Gambar S16 , Informasi Pendukung).
Perakitan Sel Planar
Setelah menyegel kompartemen katode dan anoda, sel planar ditutup pada kedua ujungnya menggunakan pelat baja tahan karat dan segel grafit melingkar. Pelat baja tahan karat dihubungkan ke silinder anoda dan katode menggunakan kabel Ni untuk sambungan listrik. Enam sekrup menggunakan ring polimer tahan suhu tinggi (untuk isolasi listrik) digunakan untuk menahan kedua pelat dan mengompresi rakitan lengkap. Pegas dimasukkan hanya di belakang kolektor Na untuk menjaganya tetap di bawah tekanan. Setelah itu, sambungan listrik dibuat ke kutub positif dan negatif dengan menggunakan kabel suhu tinggi. Pengaturan dipanaskan hingga 300 °C, dan suhu operasi dipantau dengan menghubungkan termokopel ke sel planar, setelah mencapai suhu operasi, sel disimpan semalam pada tegangan sirkuit terbuka (OCV) sebelum evaluasi elektrokimianya.
Investigasi Elektrokimia Sel Tubular
Kinerja elektrokimia tubular diselidiki dalam oven pada suhu 300 °C dalam atmosfer sekitar. Pertama, sel dipanaskan hingga suhu operasi dan dijaga pada OCV selama 48 jam. Kemudian, siklus galvanostatik dengan pembatasan potensial (GCPL) diterapkan dalam jendela kapasitas 10–100% SoC, dan dalam jendela tegangan 1,65–2,55 V versus Na + /Na. Pengukuran spektroskopi impedansi elektrokimia potensiostatik (PEIS) dilakukan pada rentang frekuensi mulai dari 1 MHz hingga 1 Hz. Teknik Titrasi Intermiten Galvanostatik (GITT) dalam jendela kapasitas 10–100% SoC pada 5 mA cm −2 dilakukan. Setelah setiap langkah sel diistirahatkan selama 6 jam untuk mencapai kesetimbangan, kemudian PEIS dilakukan.
Investigasi Elektrokimia Sel Planar
Investigasi elektrokimia sel planar dilakukan di dalam glovebox berisi argon menggunakan kubus pemanas buatan sendiri. Suhu setiap sel dikontrol selama siklus oleh termokopel yang terhubung ke setiap sel dan ditetapkan pada 300 °C. Siklus aktivasi dan evaluasi stabilitas dilakukan menggunakan GCPL dalam rentang kapasitas 10–100% SoC, dan rentang tegangan 1,65–2,60 V versus Na + /Na. Selain itu, PEIS dilakukan pada berbagai tahap: sebelum siklus aktivasi (selama langkah pemanasan), pada 0% SoC dan 100% SoC selama siklus aktivasi, dan pada 10% SoC selama evaluasi stabilitas, yang mencakup rentang frekuensi 1 MHz – 1 Hz. GITT pada sel planar dilakukan dalam jendela kapasitas 10–100% SoC, setiap langkah meliputi pengisian/pengosongan pada 10 mA cm −2 selama 1,8 jam, diikuti dengan istirahat hingga tegangan sel stabil dengan variasi kurang dari 0,1 mV h −1 diperoleh.
Analisis Postmortem Sel Tubular
Untuk pemeriksaan post-mortem, sel T1 yang telah didaur ulang (pada 0% SoC) dan T2 (pada 100% SoC) dibongkar pada suhu ruangan. Casing sel dibuka dengan hati-hati, dan setelah logam Na dinetralkan, elektrode positif diekstraksi. Elektrode ini berisi butiran, NaAlCl4 , batang Ni (berfungsi sebagai pengumpul arus), dan serat karbon. Elektrode positif kemudian dipindahkan ke kotak sarung tangan berisi argon untuk mencegah reaksi antara NaAlCl4 dan kelembapan atmosfer.
Postmortem Sel Planar
Analisis for-mortem, sel-sel dilepaskan ke 0% SoC dan kemudian dibiarkan dingin secara alami. Elektroda positif diekstraksi secara penuh menggunakan mesin pengepres. Setelah ekstraksi, partikel padat lepas NaCl dan elektrolit sekunder dihilangkan. NaCl dan NaAlCl4 yang tersisa dibersihkan menggunakan isopropanol, diikuti dengan pembilasan menyeluruh dengan etanol dan air DI untuk menghilangkan semua kontaminan dari elektroda positif. Busa yang diekstraksi kemudian dikeringkan semalaman pada suhu 100 °C dalam kondisi ruangan. Setelah kering, busa tersebut ditanamkan dalam resin EpoFix, digiling hingga dimensi yang diinginkan, dan dipoles menggunakan amplas SiC (P1200 dan P4000) di bawah aliran air konstan untuk karakterisasi selanjutnya.
Karakterisasi
Bahan elektroda positif dikarakterisasi menggunakan mikroskop elektron sekunder (SEM) meja Thermo Scientific. Difraksi serbuk sinar-X (XRD) dilakukan dengan difraktometer PANalytical yang memanfaatkan radiasi Cu Kα (λ = 1,54178 Å). Pengukuran adsorpsi dilakukan pada 77 K dalam atmosfer kripton. Data elektrokimia untuk sel planar dikumpulkan menggunakan Biologic Lab SP3E, sedangkan kinerja siklus rakitan sel tubular dievaluasi dengan SP150 yang terhubung ke booster Biologic 20A. Untuk mengevaluasi kinerja siklus sel yang independen dari kerapatan arus yang diterapkan, resistansi sel rata-rata R avg diturunkan dari efisiensi tegangan η pada kerapatan arus pengisian/pengosongan tertentu I charge / I discharge , dengan asumsi tegangan kesetimbangan V eq 2,03 V untuk sel Na-ZnCl 2 . [ 8 , 14 ]